
Особенности обмена веществ у детей (И. Н. Усов, Л. Н. Астахова)
Обмен белков. В организме ребенка имеет место выраженное преобладание анаболических процессов, направленное на обеспечение его роста и развития. В связи с этим особое значение для детей имеют белки, главнейшая функция которых - пластическая. Аминокислоты, образующиеся при распаде белков пищи, используются для синтеза белков тканей, ферментов, биологически активных веществ - гормонов, медиаторов. Белкам свойственны опорная, сократительная, транспортная, защитная, регуляторная, энергетическая функции.
Основным источником их в первые месяцы жизни является материнское молоко, в дальнейшем - мясо, рыба, молочные продукты, яйца и др. Потребность ребенка в белках составляет в среднем 2,5 - 4 г на 1 кг массы, тогда как у взрослого она значительно меньше и не превышает 1 - 1,5 г на 1 кг массы.
Для обеспечения нормального роста и развития ребенку необходимо получать с пищей белки, включающие все незаменимые аминокислоты. В состав рациона ребенка в возрасте до 3 лет должно входить не менее 75% полноценных белков, от 3 до 7 лет - 60% и от 7 до 14 лет - 50 %. По содержанию незаменимых аминокислот для грудных детей наиболее подходящими являются белки материнского молока.
Критерий здоровья растущего организма - положительный азотистый баланс. Причем чем меньше возраст ребенка, тем значительнее у него выражена ретенция азота. Высокому уровню ее соответствует большая степень всасывания белков в желудочно-кишечном тракте у детей.
При грудном вскармливании часть альбуминов и глобулинов молока всасывается из кишечника, не расщепляясь предварительно. В результате этого в организм детей первых месяцев жизни поступают антитела и антитоксины.
Переваривание белков в желудке начинается под влиянием пепсина. Из-за низкой кислотности желудочного сока активность его у грудных детей невелика. В результате действия протеолитических ферментов желудка образуются пептоны, несложные полипептиды. Они поступают в кишечник, где, подвергаясь влиянию протеаз поджелудочной железы и кишечника - трипсина, химотрипсина, карбоксипептидазы, амино-, имино- и дипептидаз, расщепляются до свободных аминокислот. Последние всасываются через стенку тонкого кишечника и попадают в кровь.
Для детей раннего возраста характерны повышенная проницаемость кишечной стенки к белкам и продуктам их распада, низкая активность протеолитических ферментов кишечника, отсутствие процесса гниения в толстом кишечнике.
Всосавшиеся аминокислоты вместе с аминокислотами, образовавшимися при распаде тканевых белков, под влиянием протеаз попадают через кровь в печень и' другие органы, где возможны различные пути превращения. Свободные аминокислоты служат материалом для синтеза новых тканевых белков, ферментов, биологически активных веществ, никотинамидных коферментов, порфиринов, пуриновых и пиримидиновых оснований, входящих в состав нуклеопротеидов, нуклеиновых кислот и др. Часть аминокислот подвергается переаминированию, дезаминированию, декар-боксилированию и другим превращениям.
Синтез специфических для организма белков находится под контролем ДНК, входящих в состав клеточных ядер. В детском возрасте биосинтез протекает со значительно большей скоростью и чувствителен к воздействию мутагенных факторов.
Образование белка в организме - энергозависимый процесс. Основные поставщики макроэргов в детском возрасте - анаэробный гликолиз и гликогенолиз, энергетический эффект которых значительно ниже, чем аэробного гликолиза. Поэтому дети особенно чувствительны к дефициту углеводов, приводящему к торможению процессов синтеза белка, падению массы и задержке роста.
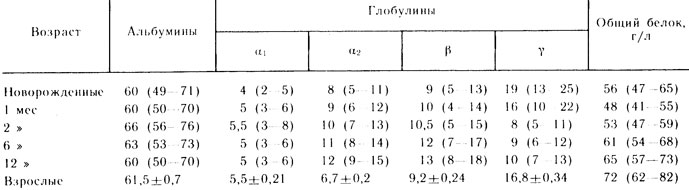
Табл. 21. Среднее содержание белковых фракций по возрастам, % от общего количества белка (по Ю. Е. Вельтищеву, 1979)
Один из путей превращения аминокислот - синтез белков плазмы и сыворотки крови, которые принимают участие в поддержании рН крови, вязкости, коллоидноонкотического давления, в транспорте различных веществ, поддержании катионов крови на определенном уровне, в свертывании крови, иммунных процессах и др. У взрослых содержание белков плазмы (сыворотки) крови в норме колеблется от 62 до 82 г/л (табл. 21). Причем на долю альбуминов приходится 40 - 50, глобулинов - 20 - 30, фибриногена - 2 г/л. Отношение альбуминов к глобулинам в норме равно 1,5 - 2,0. В первые 6 месяцев жизни содержание белков плазмы у детей ниже, чем у взрослых. Это объясняется тем, что скорость синтеза тканевых белков выше, чем белков плазмы. К концу 1-го года концентрация последних приближается к уровню взрослых. У новорожденных отмечается более высокое содержание у-глобулинов и соответственно низкое - а- и р-глобулинов. К 3 годам отмеченные сдвиги полностью нивелируются и соотношение всех фракций белков крови существенно не отличается от показателей у взрослых.
В клетках растущих тканей ребенка повышена концентрация аминокислот, что свидетельствует об активном транспорте их через клеточные мембраны. Содержание аминокислот в пуповинной крови вследствие нагнетающей функции плаценты выше, чем в крови детей более старшего возраста. У новорожденных повышена экскреция с мочой аминокислот - глицина, серина, аспарагина, лизина, гистидина, треонина, пролина и др. В первые месяцы жизни в моче определяется также этаноламин, гомоцитруллин, пролин, оксипролин. Эта так называемая физиологическая гипераминоацидурия говорит о незавершенности развития транспортных систем почечных канальцев для аминокислот в раннем детстве (Ю. Е. Вельтищев с соавт., 1983).
Функциональные группы свободных аминокислот широко вовлекаются в различные реакции обмена веществ. Прежде всего это относится к аминогруппам, участвующим в процессах переаминирования и дезаминирования. Первый путь имеет наибольшее значение для организма. В реакциях переаминирования принимают участие пиридоксалевые ферменты трансаминазы, механизм действия которых заключается в переносе аминогруппы одной a-аминокислоты с образованием второй a-аминокислоты. Пиридоксалевая группа связана с ферментом, действующим при этом как посредник. Наибольшей активностью из них обладают аспартатаминотрансфераза (АсТ) и аланинаминотрансфераза (АлТ).
Процессы переаминирования у детей протекают интенсивнее, чем у взрослых, о чем свидетельствует высокая активность в сыворотке крови АсТ и АлТ, особенно у новорожденных. В связи с этим в детском возрасте отмечается и большая потребность в витамине В6 (пиридоксине).
Один из путей катаболизма аминокислот - ферментное декарбоксилирование, приводящее к образованию биогенных аминов: гистамина из гистидина, серотонина из окситриптофана, у-аминомасляной кислоты из глутаминовой, тирамина из тиразина и др. Коферментом декарбоксилаз является также пиридоксальфосфат. Возникшие при декарбоксилировании амины обезвреживаются при участии моноамино- и диаминооксидаз. При дезаминировании моноаминов синтезируются аммиак и альдегиды, подвергающиеся в организме дальнейшим превращениям.
Другой процесс катаболизма аминокислот представляет собой их окислительное дезаминирование, идущее с появлением аммиака и кетокислот. Среди дегидрогеназ высокой активностью обладает лишь НАД-зависимая глутамат-дегидрогеназа (ГДГ), принимающая участие в дезаминировании не только 1-глутаминовой кислоты, но и других аминокислот.
Образовавшиеся при деградации аминокислот продукты подвергаются различным превращениям. Так, углекислый газ используется для синтеза щавелевоуксусной кислоты, пуриновых и пиримидиновых оснований, мочевины, жирных кислот и частично выделяется из организма. Кето- и органические кислоты идут на синтез новых аминокислот, гликогена, глюкозы, жиров, ацетоновых тел, могут окисляться в цикле Кребса.
Аммиак, будучи токсическим продуктом, быстро обезвреживается путем взаимодействия с глутаминовой или аспарагиновой кислотой, в процессе которого образуются соответствующие амиды. Особое место этот процесс занимает в головном мозге, где содержание глутаминовой кислоты в 10 раз выше, чем в крови. В почках аммиак используется для нейтрализации кислот, при этом образуются аммонийные соли. Синтез мочевины, происходящий в орнитиновом цикле, является основным путем нейтрализации аммиака в организме, а мочевина - главным конечным продуктом азотного обмена у человека.
Главный путь нейтрализации аммиака у урокотелических животных (рептилий, птиц) - синтез мочевой кислоты, являющейся у человека конечным продуктом метаболизма пуриновых оснований. Процесс образования мочевины и мочевой кислоты у ребенка подвержен значительным возрастным колебаниям. У детей он идет менее интенсивно, чем у взрослых, в связи с низкой активностью ферментов, принимающих участие в ее синтезе.
Своеобразие белкового обмена у детей проявляется в иных количественных соотношениях, чем у взрослых, продуктов азотистого обмена, выводимых с мочой. Моча плода содержит лишь следы мочевины и избыток мочевой кислоты, что сопровождается отложением последней в почечной ткани, развитием "мочекислого инфаркта" новорожденных. Первые 3 месяца жизни характеризуются наибольшей экскрецией мочевой кислоты и относительно низкой - мочевины.
У взрослых общее количество азота, выделяемого с мочой за сутки, составляет 10 - 18 г. Из них более 80 % приходится на долю мочевины. В детском возрасте содержание азота значительно ниже. Суточная экскреция его у новорожденных находится в пределах 0,3 - 0,5 г, с возрастом она увеличивается и к 10 - 14 годам достигает 9 - 10 г. Азот мочевины у ребенка 7-дневного возраста составляет 74,0%, аммиака - 8,7%, мочевой кислоты - 6,3 % и азот других веществ - 11,0 %; у взрослых соответственно - 84,9 %, 3,5 %, 2,0 %, 9,6 %. Помимо мочевины, мочевой кислоты, аминокислот, аммиака с мочой выводятся также креатинин, креатин, индикан и др.
Низкое содержание аммиака в моче после рождения резко возрастает к концу 1 - 2-й недели и остается достаточно высоким в течение всего 1-го года жизни.
У детей наблюдается физиологическая креатинурия: у мальчиков - до 10 лет, у девочек - до 12 - 16 лет. В моче взрослых обнаруживаются только следы креатина. Процент азота креатина к азоту мочи в первые дни жизни составляет 0,7 - 0,8, к году - 0,3 - 0,4, что связано с недостаточностью ферментативных систем в мышцах, осуществляющих его обмен. Креатин лишь в малой степени переходит в креатинин и, оставаясь неиспользованным, приводит к креатинурии. Суточная экскреция последнего с мочой увеличивается с возрастом.
Моча здоровых детей содержит также следы индикана. Количество его увеличивается при усилении гнилостных процессов в кишечнике.
Для всех детей характерен положительный азотистый баланс - необходимое условие для роста: наиболее высокая усвояемость азота в организме наблюдается в первые месяцы жизни, затем она постепенно снижается и у детей 2 - 3 лет составляет 30 %, 4 - 6 лет - 25 %, 7 - 8 лет - 21%, 11 - 13 лет - 13,8%. У взрослых, как правило, устанавливается азотистое равновесие. У детей показатели азотистого обмена подвержены большим индивидуальным колебаниям и в значительной степени зависят от количества и качества белка в пище, соотношения его с другими ингредиентами (углеводами, жирами, витаминами), конституциональных особенностей организма.
Обмен липидов. Липиды - группа разнообразных соединений, плохо растворимых в воде, общей особенностью которых является наличие в их молекуле остатков жирных кислот.
Нейтральные жиры (триглицериды) - жизненно важные компоненты, необходимы как источник и резерв энергии. При сгорании 1 г жира освобождается 9,0 ккал тепла. Триглицериды участвуют в образовании биологически активных веществ, выполняют защитную, теплоизолирующую функцию, обеспечивают усвоение витаминов A, D, Е, К, входят в состав клеточных мембран.
Холестерин - представитель стеринов - служит предшественником целого ряда жизненно важных соединений: жирных кислот, половых гормонов, гормонов коры надпочечников, витамина D, участвует в процессе миелинизации нервной ткани, обладает способностью связывать токсины.
Фосфолипиды предотвращают свободное окисление биологически активных веществ, препятствуют отложению жира в печени (липотропный эффект), входят в состав клеточных мембран, ткани мозга, противоате-лектатического фактора (сурфактанта), принимают непосредственное участие в процессах мембранного транспорта.
Гликолипиды - ганглиозиды, цереброзиды - являются составной частью печени, селезенки, эритроцитов, серого вещества головного мозга.
Полиненасыщенные жирные кислоты (линолевая, линоленоВая, арахидоновая) входят в состав структур митохондрий клеток и по ряду характеристик приравниваются к витаминам (витамин U), предотвращают отложение холестерина в стенках сосудов, необходимы для нормального формирования и роста нервной ткани, кожи, синтеза простагландинов.
Транспортной формой липидов в организме являются а- и р-липопротеиды. Кроме того, липиды циркулируют в биологических жидкостях в виде эмульсий - хиломикронов. Особую транспортную форму их представляют неэстерифицированные жирные кислоты (НЭЖК), адсорбированные на альбуминах плазмы.
Растущий организм нуждается преимущественно в жирах животного происхождения, содержащихся в молоке, сливочном масле, яичных желтках. Однако в рацион ребенка должны включаться и растительные жиры, лучше всего, если они составляют 10 - 15 % от общего количества жира. Чем меньше возраст ребенка, тем выше у него потребность в жирах. Так, у грудных детей она равна 5 - 7 г на 1 кг массы тела, у 3 - 4-летних - 3,5 - 4 г, у детей дошкольного и школьного возраста - около 2,5 - 3 г на 1 кг массы тела в сутки. Важно, чтобы соотношение между жирами и углеводами в пище составляло 1:2.
У грудных детей переваривание жиров начинается в желудке под влиянием липазы, активируемой липолитическими ферментами материнского молока. В процессе роста доминирующее значение переходит к липазе панкреатического сока и желчным кислотам, количество которых с возрастом увеличивается. Активированная панкреатическая липаза расщепляет нейтральные жиры до ди- и моноглицеридов, свободных жирных кислот и глицерина. Заключительные этапы процесса всасывания липидов осуществляются в клетках слизистой оболочки кишечника. Высшие жирные кислоты и моноглицериды вступают друг с другом в реакцию реэстерификации, образуя триацилглицериды. Этот процесс является энергозависимым и протекает при участии АТФ и коэнзим-А-производных.
Вместе с холестерином ресинтезированный триацилглицерид проходит сквозь боковую поверхность клетки в виде крупной липидной капли (хиломикрон), окруженной тонким слоем белков и фосфолипидов и проникающей в лимфатические сосуды. Исключение составляют жирные кислоты с короткой углеродной цепью, содержащиеся в липидах молока, которые попадают из кишечника непосредственно в кровь воротной вены, а затем в печень. Этот путь имеет важное значение для грудных детей, в рационе которых преобладают жиры молока.
Повышенная проницаемость кишечной стенки у детей способствует более быстрому всасыванию продуктов гидролиза жира. Около 5 % пищевых жиров у взрослых выводится с калом, у детей количество непереваренных жиров несколько выше - в среднем 6 - 10%. У грудного ребенка жиры выводятся в основном в виде щелочно-земельных мыл и в меньшей степени - в виде нейтрального жира. Потеря жира с калом у недоношенных еще выше из-за низкой активности липазы и меньшего количества образующейся желчи.
Первым этапом на пути попавших в лимфатические сосуды хиломик-ронов являются легкие, регулирующие поступление жира в артериальную кровь. При большой концентрации часть жиров может задерживаться в ме-зенхимальных клетках этого органа.
После приема жирной пищи развивается алиментарная гиперлипемия, наибольшая выраженность которой отмечается через 4 - 6 ч. К концу 9-го ч уровень жира в крови возвращается к норме. У детей максимум пищевой липемии выявляется уже через 3 ч и наблюдается в течение 9 ч. Из крови жиры поступают в печень, жировое депо и другие ткани, где подвергаются соответствующим превращениям.
Ведущее место в обмене липидов занимает печень. Содержащиеся в хило-микронах триглицериды на мембране печеночной клетки под действием фермента липопротеидлипазы распадаются на глицерин и жирные кислоты, которые, поступив в клетку, используются для синтеза жиров и окисляются. Расщепление триглицеридов хиломикронов в капиллярах печени и жировой ткани приводит к просветлению плазмы крови. Последнее ускоряется гепарином, активирующим липопротеидлипазу. Другой важнейший источник поступающих в печень липидов - неэстерифицированные жирные кислоты. Они освобождаются из жировых депо и переносятся кровью в ткани с интенсивным обменом, что является главным механизмом мобилизации энергии в организме.
Энергетическая эффективность окисления одной молекулы глицерина составляет 22 молекулы АТФ. Окисление жирных кислот протекает в 2 этапа: I - активирование жирной кислоты с образованием ацилкоэнзима А, II - собственно 6-окисление, в результате которого образуется укороченный на два углеродных атома ацилкоэнзим А и одна молекула уксусной кислоты в виде ацетилкоэнзима А, который подвергается окислению в цикле трикарбоновых кислот, а ацилкоэнзим А снова проходит весь путь окисления.
В процессе 8-окисления образуется ацетилкоэнзим А, который может вступать в реакцию конденсации с еще одной подобной молекулой, при этом выделяется ацетоуксусная кислота. В результате постоянно освобождается коэнзим А. Ацетоуксусная кислота в тканях расщепляется с образованием двух молекул ацетилкоэнзима А, окисляющихся в цикле Кребса с выделением энергии. Включение образовавшихся молекул ацетилкоэнзима в цикл три-карбоновых кислот может идти лишь в присутствии достаточного количества щавелевоуксусной кислоты. Недостаток последней ведет к повышенному образованию ацетоновых тел в организме.
Биосинтез жира протекает во многих тканях, но наиболее интенсивно - в печени, кишечнике, жировой ткани. В процессе его как промежуточный продукт образуется фосфатидная кислота, которая может взаимодействовать с холином для образования лецитина. Под влиянием фосфатазы она превращается в а-, р-диглицерид. Завершающая стадия синтеза триглицеридов протекает при реакции диглицерида с ацилкоэнзимом А.
Высокой метаболической активностью в отношении жирового обмена характеризуется ткань жирового депо. Клетки ее обладают способностью синтезировать жирные кислоты и служат энергетическим потребностям организма. При голоде или повышенных затратах энергии происходит расщепление и мобилизация нейтрального жира из депо. Освобождающиеся при липолизе свободные жирные кислоты и глицерин поступают в кровь и окисляются в тканях с выделением энергии. Кроме того, в жировой ткани протекают процессы превращения углеводов в жиры, связанные с высокой интенсивностью прямого окисления глюкозы. Поэтому при увеличении в пище количества углеводов отмечается наибольшее отложение жира в депо.
У ребенка значительная часть жира депонируется в подкожной клетчатке и брюшине. Преобладание процессов отложения его над использованием сочетается у маленьких детей с легкой истощаемостью жировых депо, что во многом объясняется несовершенством нейрогуморальных механизмов регуляции.
В период новорожденности особую роль играет бурая жировая ткань, которая характеризуется реакцией на адреналин и мобилизацией НЭЖК. Она представляет собой своеобразный орган теплорегуляции, где протекает свободное окисление жирных кислот с выделением тепла. Жировая ткань ребенка содержит большее, по сравнению со взрослыми, количество диглицеридов, пальмитиновой кислоты, воды, гликогена, ДНК, фосфолипидов и меньшее - нейтральных жиров, ненасыщенных жирных кислот с длинной углеродной цепью, холестерина.
В жировой ткани детей всех возрастов отмечается более интенсивное, чем у взрослых, окисление жирных кислот, активное включение глюкозы в биосинтез жирных кислот и триглицеридов и более высокая концентрация коэнзима А.
Основным источником холестерина для грудных детей является материнское молоко, а в дальнейшем такие продукты питания, как яичный желток, мясо, печень и др. При естественном вскармливании содержание его в крови на 10 - 15 % выше, чем при вскармливании коровьим молоком.
Большая часть холестерина в кишечнике образует мицеллы с солями желчных кислот и в составе хиломикронов попадает в общий кровоток. Значительное количество его задерживается в печени, где подвергается эстерификации, взаимодействуя с коэнзим-А-производными жирных кислот и образуя сложные эфиры, либо превращается в соли желчных кислот.
В организме имеет место и эндогенный синтез холестерина из ацетилкоэнзима.А по скваленовому типу. Образующийся в печени холестерин покидает ее двумя путями: часть его попадает в кровоток и подвергается эстерификации, а другая выводится вместе с солями желчных кислот.
В крови холестерин находится как в свободном состоянии, так и в соединении с жирными кислотами. Если у новорожденного на долю свободного холестерина приходится 65 %, то к концу первых суток соотношение между этими формами выравнивается, а затем начинает сдвигаться в сторону преоб-, ладания эфиросвязанной формы при увеличении общего холестерина в сыворотке крови (табл. 22).
Табл. 22. Липидные фракции сыворотки крови у детей (М±о) (по Hering, Silvia, 1966)
Основной источник фосфатидов в грудном возрасте - молоко, содержащее в достаточном количестве лецитины и кефалины. Позднее ребенок получает их с яичным желтком, железистыми тканями и другими продуктами, на которые в кишечнике действует комплекс специфических фосфолипаз. После всасывания в эпителиальных клетках кишечника происходит ресинтез фосфатидов, откуда они с током крови переносятся в печень. В клетках ее фосфолипиды распадаются на структурные компоненты, которые в дальнейшем подвергаются превращениям, являясь источником энергии или включаясь в синтез биологически активных соединений. Одновременно с распадом в печени идет постоянный ресинтез фосфатидов. Образование их необходимо для обновления структурных фосфолипидов в мембранах самой печени, других тканях и обеспечения диацилглицеридов, участвующих в биосинтезе жиров в печени.
Фосфолипиды постоянно содержатся - в крови (на долю лецитина приходится около 55 %, кефалина - около 21 %). Уровень их с возрастом постепенно увеличивается (табл. 22). Большое значение имеет определение соотношения между фосфолипидами и холестерином (в норме около 1), поскольку лецитин повышает растворимость последнего, способствуя переходу его в печень и выведению из организма.
Липидный обмен в организме регулируется эндокринной и центральной нервной системой. Нейрогуморальное влияние в первую очередь сказывается на процессах мобилизации жирных кислот из депо.
Глюкокортикостероиды, катехоламины, глюкагон, тироксин, гормон роста, АКТГ активируют липолиз и освобождение НЭЖК. Противоположный эффект оказывают инсулин, простагландины. Стресс, физическая нагрузка, голодание, охлаждение усиливают липолиз.
Немаловажное значение в регуляции жирового обмена имеет характер питания. Длительное избыточное потребление жиров и углеводов приводит к усиленному отложению жира. Между жировым и углеводным обменом - главными энергообразующими процессами в организме существует взаимо-регулирующее влияние. Так, увеличение концентрации глюкозы в жировой ткани и повышение скорости гликолиза угнетает липолиз. При истощении запасов углеводов, снижении интенсивности расщепления глюкозы усиливается липолиз, в результате чего ткани получают для окисления повышенное количество жирных кислот.
Особенностями детского возраста являются неустойчивость и лабильность обмена липидов, повышенная липолитическая активность жировой ткани к адреналину и глюкагону. Последняя приводит к быстрой мобилизации липидов из жировых депо и их истощению, о чем свидетельствуют более высокие цифры НЭЖК в сыворотке крови у детей раннего возраста.
Количественное соотношение классов липидов в сыворотке крови, в известной мере, отражает состояние липидного обмена у детей разного возраста (табл. 22). В целом ранние периоды развития ребенка характеризуются более низкими показателями липидов и относительно малой активностью липолитических ферментов сыворотки крови. У них чаще, чем у старших детей и взрослых, развивается синдром дефицита полиненасыщенных жирных кислот.
У детей до 7 - 10 лет отмечается повышенная склонность к кетозам. Гиперкетонемия и кетонурия могут развиваться под влиянием кратковременного голода, переутомления, переедания, инфекций, стресса. Это связано с неустойчивостью углеводного обмена, малыми запасами гликогена, особенностями обмена кетогенных аминокислот, замедленным окислением кетоновых тел в тканях и выведением их из организма.
Обмен углеводов. Углеводы относятся к многоатомным спиртам, содержащим альдегидную и кетонную группы. Они являются основным источником энергии как у взрослых, так и у детей. При окислении 1 г углеводов выделяется 3,75 ккал, которые могут аккумулироваться в АТФ или выделяться в виде тепла. Углеводы выполняют пластическую функцию, входя в состав многих структур организма: нуклеиновых кислот, мембран клеток, основного вещества соединительной ткани и др., могут быть и резервом питания. Биологический полимер глюкозы - гликоген при полноценном питании накапливается в печени (до 10 %) ив скелетных мышцах (до 2 %).
В комплексе с белками углеводы влияют на проницаемость клеточных мембран, проведение нервных импульсов, образование антител, определяют специфичность групп крови, индивидуальные особенности тканей. Углеводные компоненты входят в состав ряда гормонов, витаминов, коферментов, участвуют в процессах свертывания крови, регенерации и др.
Потребность в углеводах растущего организма весьма значительна. В грудном возрасте она составляет 10 - 12 г на 1 кг массы тела в сутки, а в более старшем- 12 - 15 г. Грудной ребенок получает за счет окисления углеводов - 40 % калорий, а за счет расщепления - 50 %. С возрастом это соотношение постепенно меняется, и взрослый человек 60 % общей потребности в энергии удовлетворяет за счет углеводов.
Углеводы поступают с пищей в виде моносахаридов (глюкоза, фруктоза), дисахаридов (лактоза, сахароза, мальтоза) и полисахаридов (крахмал, гликоген). В первые месяцы жизни основным углеводом пищи является лактоза, состоящая из глюкозы и галактозы. Содержание ее (Р-лактоза) в женском молоке составляет в среднем 70 г/л, в коровьем (а-лактоза) - 48 г/л.
Переваривание углеводов начинается в ротовой полости. Под действием амилазы слюны происходит расщепление крахмала и гликогена до декстринов и мальтозы. Амилаза в слюне обнаруживается уже у плода, однако активность ее в это время еще незначительна. В возрасте 3 - 5 месяцев она начинает постепенно повышаться, достигая максимума к 1 - 4 годам. К этому времени в слюне ребенка выявляется также фермент мальтаза, отсутствующий у грудных детей.
В желудке действие амилазы практически прекращается. В двенадцатиперстной кишке после нейтрализации соляной кислоты бикарбонатами панкреатического сока создаются все условия для дальнейшего гидролиза остатков крахмала, декстринов и дисахаров.
Амилаза панкреатического сока способствует деградации остатков крахмала. Невысокая амилолитическая активность у детей 1-го года жизни значительно увеличивается к 4 - 9 годам. В кишечнике содержатся также сахароза, мальтоза, лактоза, расщепляющие соответствующие дисахариды до моносахаридов: сахароза - До а-глюкозы и р-фруктозы; мальтоза - до а-глюкозы и а-глюкозы; лактоза - до а-глюкозы и р-галактозы. Наибольшей активностью у детей обладает мальтоза, чем и объясняется высокая переносимость ими декстринмальтозных смесей, широко используемых в питании детей грудного возраста.
В период грудного вскармливания переваривание углеводов происходит почти исключительно на поверхности микроворсинок кишечника (мембранное переваривание). Недостаточная активность гидролитических ферментов у детей этого возраста замедляет расщепление Сахаров при искусственном вскармливании, в ряде случаев приводит к увеличению их сбраживания и расстройствам пищеварения.
В кишечнике ребенка всасываются в основном моносахариды и в очень малом количестве дисахариды. У детей первых 2 лет жизни глюкоза резорбируется быстрее, чем у взрослых. В грудном и более старшем возрасте усваивается 98 - 99 % всех углеводов пищи.
Всасывание глюкозы и галактозы связано с процессами активного транспорта, резорбция фруктозы и пентоз происходит путем диффузии. По скорости всасывания углеводы могут быть размещены в следующем порядке: галактоза, глюкоза, фруктоза, манноза. Глюкоза уже при прохождении через клетку слизистой оболочки может частично окисляться и использоваться в качестве энергетического материала, фруктоза и галактоза - превращаться в глюкозу. Процесс перехода галактозы в глюкозу у детей выражен недостаточно из-за низкой активности галактозо-1-фосфат-уридилтрансферазы, в связи с чем галактоземия в раннем возрасте протекает особенно тяжело.
Моносахариды из крови быстро поглощаются паренхиматозными клетками печени, где происходит преобразование фруктозы и галактозы в глюкозу. В клетках при участии АТФ и фермента гексокиназы глюкоза фосфорилируется с образованием глюкозо-6-фосфата. Благодаря этому концентрация свободной глюкозы внутри клетки всегда оказывается ниже, чем во внеклеточном пространстве, что обеспечивает постоянное поступление ее в клетку. Активность гексокиназ выявляется в тканях сразу после рождения. В плазме крови новорожденных она наибольшая, с возрастом постепенно уменьшается.
Образовавшийся в ходе гексокиназной реакции глюкозо-6-фосфат - один из узловых метаболитов углеводного обмена, который может вступать на путь различных превращений: синтеза гликогена и мукополисахаридов, образования свободной глюкозы, дихотомического (анаэробного и аэробного) и апотомического (пентозный цикл) окисления.
Анаэробный гликолиз является основным процессом преобразования глюкозы в работающей скелетной мышце, эритроцитах и представляет собой серию последовательных реакций, протекающих без участия кислорода с образованием молочной кислоты. Энергетическая активность его невысока. Конечный продукт анаэробного окисления глюкозы - молочная кислота. В сутки ее синтезируется до 20 - 30 г. Утилизация молочной кислоты может идти в двух направлениях: на ресинтез гликогена и дальнейшее окисление до пировиноградной кислоты.
Основной путь окисления глюкозы в организме аэробный. Протекает он в 3 этапа: 1) гликолиз с образованием пировиноградной кислоты; 2) окислительное декарбоксилирование пировиноградной кислоты до ацетилкоэнзи-ма А (ацетил-КоА); 3) окисление последнего в цикле Кребса до углекислого газа и воды. Энергетический баланс аэробного окисления глюкозы значительно выше, чем анаэробного, и составляет 38 молекул АТФ.
Другой путь преобразования глюкозо-6-фосфата - пентозный цикл, характеризующийся последовательным укорочением молекулы глюкозы до пентозы. В нем выделяют 2 фазы: окислительную и неокислительную. Конечным продуктом первой фазы является рибулезо-5-фосфат. При этом выделяется 36 молекул АТФ. В неокислительной фазе из 6 молекул рибулезо-5-фосфата образуется 5 молекул глюкозо-6-фосфата. Следовательно, в ходе пентозного цикла синтезируется 36 молекул АТФ, т. е. почти столько же, сколько при аэробном окислении глюкозы, однако выделение их происходит значительно
быстрее, при участии меньшего количества ферментов и вне зависимости от цикла Кребса. Кроме того, пентозный цикл служит главным поставщиком восстановленных адениловых нуклеотидов в организме, необходимых для биосинтеза липидов, пентоз, нуклеотидов и нуклеиновых кислот.
Отложение углеводов в депо возможно лишь после полимеризации молекул глюкозы с образованием гликогена, в котором участвуют многие ферменты, обеспечивающие ветвистое строение его молекул (чередование 1 - 4 и 1 - 6 связей).
Гликогенолиз - расщепление молекул гликогена - осуществляется в несколько этапов при участии соответствующих ферментов. В печени процесс заканчивается высвобождением свободной глюкозы, в мышцах образуются фосфорные эфиры (глюкозо-1-фосфат, глюкозо-6-фосфат), подвергающиеся дальнейшему окислению. При недостатке кислорода глюкозо-6-фосфат преобразуется в молочную кислоту, из которой в печени вновь синтезируется гликоген.
Регуляция углеводного обмена осуществляется центральной нервной системой с включением ряда жизненно важных гормонов. Гормон поджелудочной железы - инсулин влияет на транспорт глюкозы через клеточные мембраны, повышая их проницаемость, стимулирует активность гексокиназы, усиливает процессы синтеза гликогена и подавляет гликонеогенез. Под его влиянием уровень сахара в крови понижается. Гормоны коры надпочечников, щитовидной железы, гипофиза (АКТГи соматотропный), адреналин и глюка-гон способствуют возрастанию концентрации сахара в крови.
Углеводный обмен у детей протекает активнее, чем у взрослых. Это связано с повышенным использованием углеводов как энергетического и пластического материала в условиях роста ребенка.
В детском возрасте окисление глюкозы в пентозном цикле отличается большой интенсивностью, что обеспечивает повышенный синтез нуклеиновых, жирных кислот, холестерина и его производных. Рост ребенка тесно связан и с процессами гликолиза. Чем меньше возраст ребенка, тем они выше. Образующаяся в ходе их молочная кислота не может быть полностью окислена из-за недостатка аэробных процессов. В результате этого уровень ее в крови повышается, что приводит к смещению кислотно-щелочного состояния в сторону ацидоза. Наиболее высока концентрация молочной кислоты у новорожденных (1,9 - 2,2 ммоль/л). С возрастом она постепенно снижается, достигая к 10 годам уровня взрослых (0,7 - 1,6 ммоль/л). Подтверждением доминирования гликолитических процессов и недостаточности аэробных у новорожденных служат повышенное количество пировинограднои кислоты (до 227 мкмоль/л) и более низкое содержание в тканях АТФ. Преобладание гликолитических процессов в ранние периоды жизни ребенка сопровождается высокой активностью таких ферментов гликолиза, как лактатдегидрогеназа, гексокиназа, альдолаза и др. С возрастом происходит интенсификация аэробных процессов, о чем свидетельствует повышение экскреции лимонной кислоты с мочой, нарастает активность ферментов цикла Кребса - изоцит-ратдегидрогеназы, сукциндегидрогеназы, малатдегидрогеназы.
Для детей характерна быстрая истощаемость углеводных запасов, что проявляется большой лабильностью уровня глюкозы в крови на протяжении дня.
В первые дни жизни у новорожденных выражена гипогликемия. Через 3-6 часов после рождения содержание истинной глюкозы составляет 2,77±1,37 ммоль/л, к 5 - 6-му дню уровень ее поднимается до 3,61±1,1 ммоль/л. С возрастом содержание ее продолжает повышаться и к 14 - 15 годам достигает значений взрослых (до 5,55 ммоль/л).
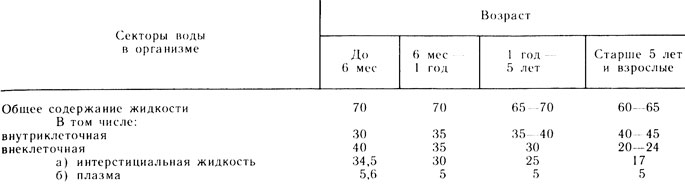
Табл. 23. Содержание и распределение воды в организме человека в зависимости от возраста, % к массе тела (по Полоновскому и Колену, 1963)
Запасы гликогена у ребенка ограничены, гликонеогенез еще недостаточно развит, поэтому основным источником глюкозы оказываются углеводы пищи. При нагрузке углеводами развивается пищевая гипергликемия, которая в раннем возрасте выражена слабее, чем у взрослых, поскольку дети более выносливы к углеводным нагрузкам.
Снижению уровня глюкозы в крови способствует отложение гликогена в печени и скелетных мышцах, выделение с мочой, окисление в тканях. Последний путь наиболее развит у детей.
В суточной моче недоношенных новорожденных определяется до 130 мг углеводов, у доношенных - до 80, причем половину из них составляет лактоза. Суточный диурез грудных детей включает до 15 мг глюкозы, до 10 мг галактозы, до 35 мг лактозы, менее 10 мг фруктозы, менее 30 мг ксилозы и арабинозы. У детей первых дней жизни, особенно недоношенных, может отмечаться галактозурия. При пероральной нагрузке галактозой у новорожденных развивается гипергликемия, так как фосфорилирование галактозы в печени у маленьких детей ограничено. Взрослые реагируют на эту нагрузку снижением содержания глюкозы в крови.
Для оценки состояния углеводного обмена в клинике используют глике-мические кривые после нагрузки глюкозой. Чтобы обнаружить сахар в моче, применяют пробы Бенедикта, Фелинга, Ниландера, а также полуколичественное определение с помощью гликотеста.
Водно-солевой обмен. Вода - важнейшая составная часть живого организма. Общее содержание ее у ребенка грудного возраста - 70 - 75 %, а взрослого - 60 - 65 % массы тела. Большая часть воды (40 - 45 % массы тела) находится внутри клеток, меньшая (25 %) - вне клеток, из которой около 20 % приходится на межтканевую жидкость и лимфу и 5 % - на плазму. Общее количество воды и ее распределение по секторам зависит от возраста (табл. 23).
Обмен жидкости в организме детей, особенно раннего возраста, проходит с большой интенсивностью и напряженностью. Потребность в воде тем выше, чем меньше возраст ребенка. Так, у новорожденного она составляет 150 - 200 мл/кг в сутки, у грудного ребенка - 100 - 150, в 2 года - 90 - 95, в 5 лет - 60, в 13 лет - 40 мл/кг массы в сутки.
Потребность в воде у детей удовлетворяется за счет питья жидкости и частично плотной пищи. Всасывание воды из желудочно-кишечного тракта и проникновение ее в кровь происходит очень быстро, интенсивно идет обмен воды между кровью и тканями. Распределение воды среди различных пространств зависит от концентрации осмотически активных веществ, содержащихся в жидкостях. Основными депо воды в организме являются кожа с подкожно-жировой клетчаткой, печень и мышцы. Из общего количества принятой ребенком жидкости в организме задерживается только около 1 %, остальная часть ее после участия в обменных процессах выводится из организма. Большое количество принятой и всосавшейся жидкости периодически возвращается в кишечник с пищеварительными соками, участвует в процессе пищеварения и опять всасывается. Таким образом, принятая за сутки жидкость 3 - 5 раз обращается между кишечником и сосудистой системой.
Около 60 % воды выводится из организма ребенка почками, до 34 % - кожей и легкими, 6 % - с испражнениями. Избыточно принятая вода выделяется преимущественно почками.
Особенно активно протекает обмен внеклеточной жидкости. Интенсивность его у ребенка раннего возраста в 2 - 3 раза выше, чем у взрослого, что связано с высокой активностью обмена веществ и большой внешней поверхностью тела ребенка. Через кожу и легкие у ребенка выводится относительно больше воды, чем у взрослого. Регуляция водного обмена у детей несовершенна, в связи с этим у них могут происходить быстрые нарушения его с образованием отеков или развитием эксикоза.
Регуляция водного обмена - сложный процесс, контролируемый центрами гипоталамической области. В нем участвуют также эндокринные железы, и прежде всего гипофиз, надпочечники, мозговой придаток и щитовидная железа. Состояние водного обмена в большой степени зависит от функции легких, сердечно-сосудистой системы, печени и почек, а также тесно связано с обменом белков, жиров, углеводов, витаминов и особенно солей.
Минеральные соли, растворенные в воде, создают основу внутренней среды организма, поддерживая осмотическое давление и рН жидкостей, относительное постоянство которых играет важную роль в нормальном течении всех важнейших биологических процессов. У детей 1-го года жизни минимальная потребность в электролитах следующая: натрий - 3,5 - 5,0 ммоль; калий - 7,0 - 10,0; хлор - 6,0 - 8,0; кальций - 2,0 - 3,0; фосфор - 1,3 - 1,7 ммоль/день (Ю. Е. Вельтищев, 1976).
Натрий является основным катионом внеклеточной жидкости, в которой также относительно много хлора и бикарбонатов. Калий - основной катион внутриклеточной жидкости, где, кроме того, повышено содержание магния и органических фосфатов. Между внутриклеточной и внеклеточной жидкостями поддерживается ионная асимметрия.
Существенных различий в ионном составе интерстициальной жидкости и плазмы крови в зависимости от возраста не выявлено. Среднее содержание натрия в сыворотке крови здоровых грудных детей - 140±0,5 ммоль/л, калия - 4,92±0,01 ммоль/л (М. П. Шейбак, 1980).
Натрий поддерживает осмотическое давление интерстициальной жидкости и плазмы, чем обеспечивается относительное постоянство их объема. В норме осмотическое давление плазмы составляет 300 - 330 мосмоль/л. Регуляция объемов межклеточной жидкости и плазмы крови осуществляется с помощью антинатрийурического и антидиуретического рефлексов, в которых участвуют волюмо- и осморецепторы, гипоталамус, задняя доля гипофиза, надпочечники, альдостерон и антидиуретический гормон, усиливающие реабсорбцию натрия и воды в дистальных и прямых почечных канальцах.
Калий обеспечивает нормальное осмотическое давление внутри клеток, в результате чего сохраняется постоянство внутриклеточного пространства, повышает возбудимость нервно-мышечной системы, способствует синтезу гликогена и белков в клетках.
Натрий и калий играют важную роль в обеспечении кислотно-щелочного состояния. Нормальный показатель рН крови колеблется в очень небольших пределах (7,37 - 7,44). Величины его ниже 6,8 и выше 7,8 несовместимы с жизнью. Постоянство концентрации водородных ионов поддерживается буферными системами: бикарбонатной, фосфатной, белковой. Наиболее важной является бикарбонатная система крови, включающая угольную кислоту (Н2СO3) и ее соли - бикарбонат натрия (NaHC03) или бикарбонат калия (KHCO3).
Основной источник натрия и хлора для организма ребенка старшего возраста - поваренная соль, добавляемая к пище, поскольку почти все пищевые продукты содержат относительно небольшое количество этих элементов. Источником калия служит преимущественно растительная пища, в которой его гораздо больше, чем в продуктах животного происхождения. При искусственном вскармливании коровьим молоком ребенок получает относительно больше электролитов и белка, чем при грудном. Поэтому, учитывая незрелость выделительных почечных механизмов у детей 1-го года жизни, при искусственном вскармливании ему необходимо давать достаточное количество жидкости.
Кальций имеет очень важное значение для растущего организма. До 98 % его сосредоточено в костях, где он связан с фосфатами и карбонатами, более 2 % - растворено в плазме и межклеточной жидкости. В плазме крови содержится 2,5 - 2,8 ммоль/л кальция в трех фракциях: 1) ионизированный, 2) в соединении с белками и другими коллоидами и 3) в комплексных соединениях. Почти половина кальция в плазме крови связана с белками, другая часть представляет собой ионизированный кальций, который более активен, поддается ультрафильтрации и свободно проходит через стенки капилляров, как через диализирующую мембрану. Важнейшие функции кальция в организме - поддержание нервно-мышечной возбудимости, тонизирование симпатического отдела вегетативной нервной системы, уплотнение пограничных зон клеток, участие в свертывании крови, построении костной ткани, регуляции кислотно-щелочного состояния.
Основной источник кальция - пища. Всасывание его активируется метаболитами витамина D: 25-гидрохолекальциферолом и особенно 1,25-дигидрохолекальциферолом, стимулирующими синтез кальцийсвязывающего белка. В регулировании равновесия кальция в плазме и костях участвует также гормон паращитовидных желез. Из организма кальций выводится преимущественно кишечником. Потребность его зависит от возраста (см. Питание здорового ребенка).
Фосфор играет исключительно большую биологическую роль для растущего организма. Около 70 % его сосредоточено в костной ткани, он входит в состав межклеточной жидкости и активных биохимических соединений каждой клетки организма. В сыворотке крови ребенка 1-го года жизни содержится 1,29 - 2,26 ммоль/л неорганического фосфора, детей 1 - 14 лет - 0,62 - 1,62 ммоль/л. Органические соединения фосфора - АТФ, АДФ - составляют основу энергетического обмена. Фосфор необходим для фосфорилирования углеводов и жиров, а также для формирования кости. Неорганические соединения его участвуют в процессах, направленных на поддержание кислотно-щелочного состояния. Источником фосфора является пища, преимущественно животного происхождения. Возрастные потребности в нем см. Питание здорового ребенка.
Сера принимает участие в синтезе белков. Поступает в организм в виде неорганических сульфатов и с белковыми соединениями, в состав которых она входит вместе с серусодержащими аминокислотами.
Железо - важнейший из элементов, необходимых для синтеза гемоглобина и ряда тканевых ферментов. Для нормального гемопоэза и развития ребенка важное значение имеют такие микроэлементы, как медь, цинк, кобальт, марганец, молибден и др.
Содержание железа и микроэлементов в женском и коровьем молоке недостаточно. Ребенок рождается с некоторым запасом их, накопленным в печени и других органах в период утробной жизни. Особенно активное поступление железа, меди и других микроэлементов в организм плода происходит в последние месяцы беременности. У доношенного новорожденного запасы железа равны 260 - 300 мг, у недоношенных значительно меньше, в связи с чем они в большей степени предрасположены к железо-дефицитной анемии. Уровень железосвязывающих белков трансферрина и ферритина в крови грудных детей в первые 2 - 3 месяца жизни заметно снижается. Это обусловлено незначительным поступлением железа с молоком, истощением его запасов и недостаточным синтезом ферритина и трансферрина. Дефицит микроэлементов особенно быстро нарастает при заболеваниях ребенка.
Медь играет важную роль в синтезе гемоглобина и созревании эритроцитов. Она связана с белком церулоплазмином, который способствует переходу двухвалентного железа в трехвалентное и образованию трансферрина. Дефицит меди снижает активность церулоплазмина и у детей грудного возраста ведет к развитию анемии.
Цинк необходим ребенку для нормального роста и развития. Он входит в состав фермента угольной ангидразы. Потребность в цинке у детей 1-го года жизни - 3-5 мг в сутки. В молоке содержится мало цинка - до, 0,65 мг/л, значительно больше в молозиве - до 20 мг/л. Дефицит цинка, которому способствуют хронические заболевания желудочно-кишечного тракта, протекающие с синдромом нарушенного всасывания, ведет к расстройствам питания и задержке роста.
Витамины. Интенсивный обмен веществ, быстрый рост и развитие ребенка возможны только при достаточном поступлении в организм витаминов. Отечественный педиатр Н. И. Лунин в 1880 году показал, что кроме белков, жиров, углеводов, воды и минеральных веществ организму жизненно необходимы еще неизвестные пищевые факторы, которые польским ученым К. Функом в 1911 - 1912 гг. были названы "витаминами" и отдельные из них выделены в чистом виде.
В настоящее время известно около двух десятков витаминов. Они играют важную биологическую роль в активации пластических процессов, являясь биокатализаторами их и материалом для синтеза ряда ферментов или веществ, действующих подобно гормонам. Недостаточное поступление в организм ребенка и нарушение их обмена ведет к развитию гиповитаминозов.
Все витамины принято разделять на две группы: 1) растворимые в жирах (А, Е, К, D) и 2) растворимые в воде (группа В: В1, В2, В5, В6, В12, В15, аскорбиновая кислота и др.). Вещества, из которых в организме могут образовываться витамины, называются провитаминами. Провитаминами, превращающимися в организме в витамин А, являются каротины. Некоторые стерины под влиянием ультрафиолетового облучения превращаются в витамин D.
Приводим краткую характеристику некоторых витаминов, часто используемых педиатрами для дополнительного введения здоровым детям при недостатке их в пище, особенно в зимне-весеннее время, и с целью повышения резистентности организма при угрозе заболевания или в случаях болезни.
Витамин А (антиксерофтальмический, антиинфекционный, витамин роста) необходим для синтеза зрительного пурпура (родопсина). При недостатке витамина снижается концентрация последнего в ретине глаз, в результате чего нарушается сумеречное зрение и развивается ночная ("куриная") слепота. Недостаток витамина А тормозит рост, нарастание массы тела, снижает резистентность к инфекциям. Этот витамин необходим также для поддержания нормальных трофических процессов в образованиях эктодермального происхождения. При нехватке его появляются сухость и шелушение кожи, ломкость ногтей, тусклость волос, сухость роговицы, конъюнктивиты и другие нарушения. Витамин А содержится преимущественно в жирах животного происхождения, в растительных - почти отсутствует. Много витамина А в яичном желтке, печени, молоке, говяжьем и особенно в рыбьем жире. Провитамин А - желтый пигмент каротин - находится в моркови и других растениях. Под влиянием каротиназы печени каротин в организме превращается в витамин А. Суточная потребность его у ребенка до 1 года составляет 0,5 мг (1600 ИЕ), у детей 1 - 6 лет - 1,0 мг (3300 ИЕ), 7 - 15 лет - 1,5 мг (5000 ИЕ).
Витамин Е (токоферол, "витамин воспроизводства") в окислительно-восстановительных процессах играет роль переносчика водорода, улучшает использование кислорода тканями. Необходим для нормального развития эмбриона, недостаток его может явиться причиной выкидыша или привести к недонашиванию. При обычном питании содержание его в пище достаточное. Большое количество витамина Е содержится в сливочном масле, молоке, зародышах пшеницы, зеленых частях растений, в желтке и других продуктах. В виде медикаментозных препаратов витамин Е назначается при экссудативном диатезе, гипохромной анемии, мышечной дистрофии, привычных выкидышах и бесплодии.
Витамин К (антигеморрагический, витамин коагуляции) усиливает образование протромбина в печени и способствует свертыванию крови. В норме у здоровых детей и взрослых синтезируется бактериями кишечника. У новорожденных, поскольку кишечник сразу после рождения почти стерилен, отмечается физиологическая гипопротромбинемия, часто ведущая к появлению геморрагического синдрома. Гиповитаминоз К может развиться при дисбактериозе кишечника в связи с длительным применением противобактериальных препаратов и при заболеваниях печени. Много витамина К в цветной капусте, шпинате, зеленых томатах и других продуктах растительного происхождения. Молоко, яйца содержат его в небольших количествах. При гипопротромбинемии часто назначают викасол по 2 - 15 мг 2 - 3 раза в день в течение 3 - 4 дней.
Витамин D (холекальциферол, антирахитический) участвует в регуляции кальциевого обмена. Витамин D и его активные метаболиты, образующиеся в цечени (25-гидроксихолекальциферол) и почках (1,25-дигидрокси-холекальциферол), стимулируют синтез кальцийсвязывающего белка и тем способствуют всасыванию кальция в кишечнике, а также усиливают отложение его в костях. Недостаток витамина D в организме ребенка раннего возраста часто приводит к развитию рахита. Суточная потребность в нем составляет 500 ИЕ.
Витамином D богаты рыбий жир, яичный желток, печень. В небольшом количестве содержится в молоке и совершенно отсутствует в растительном масле, зеленых частях растений и овощах. Под влиянием ультрафиолетовых лучей может синтезироваться в коже ребенка и взрослого человека из провитаминов (стероловых соединений). Избыточное введение витамина D в организм ребенка может вызвать явление гипервитаминоза. Последний чаще наблюдается у детей, родившихся с малой массой, недоношенных, страдающих гипотрофией, находящихся на искусственном и смешанном вскармливании, в случаях повышенной всасываемости кальция в кишечнике (идиопатическая гиперкальциемия), а также при высокой индивидуальной чувствительности ребенка к витамину D.
Водорастворимые витамины из группы В и витамин С (аскорбиновая кислота) - активные катализаторы окислительно-восстановительных процессов. Витамины группы В являются основой для образования коферментов и простетических групп ферментов, осуществляющих ряд важнейших реакций обмена веществ.
Витамин В1(аневрин, тиамин) входит в состав фермента кокарбокси-лазы (тиаминдифосфат), с помощью которого осуществляется декарбоксилирование промежуточных продуктов расщепления углеводов. Тиаминдифосфат представляет собой кофермент энзиматических систем, осуществляющих окислительное декарбоксилирование а-кетокислот. При дефиците тиамина в организме накапливаются пировиноградная и молочная кислоты. Необходим для растущего организма как важный фактор, регулирующий деятельность нервной системы. При авитаминозе В, развивается типичная полиневритическая форма гиповитаминоза - болезнь бери-бери, распространенная в странах, где в питании используется преимущественно полированный рис. Ю. Ф. Домбровская (1963) рекомендует применять витамин В, у детей при секреторных и дискинетических расстройствах желудочно-кишечного тракта, нарушениях углеводного обмена, дистрофии, гипоксемии, функциональных и органических расстройствах центральной нервной системы, снижении функции гипофиза и поджелудочной железы, анемии постинфекционного характера.
Витамин В, содержится в растительных продуктах. Особенно много его в зародышах и оболочках злаков (отрубях), дрожжах. Суточная потребность, в тиамине на 1-м году составляет 0,5 мг, в более старшем возрасте - 1,0 - 2,0 мг.
Витамин В2(рибофлавин) входит в состав ряда ферментов, участвующих в энергетическом обмене, является важным катализатором тканевого дыхания. Функционально связан с действием в организме других водорастворимых витаминов (В1, В5, С), необходим для нормального обмена углеводов, белков и жиров. При недостатке рибофлавина развивается глоссит, конъюнктивит, кератит, дерматит, ангулярный стоматит. Нарушение усвоения витамина В2 при расстройствах пищеварения ведет к развитию спруподобного синдрома.
Рибофлавин распространен во многих продуктах растительного и животного происхождения. В больших количествах содержится в злаках, дрожжах, молоке, яйцах, печени, почках, мышцах крупного рогатого скота. Суточная потребность в витамине В2 у детей - 1,0 - 3,0 мг.
Витамин РР, или В3(никотиновая кислота), входит в состав никотинамидных коферментов, являющихся частью дегидрогеназ, катализирующих окислительно-восстановительные реакции. Многие исследователи полагают, что никотиновая кислота является как бы провитамином, который в организме человека и животных превращается в никотинамид, обладающий противопелларгическим эффектом,- витамин PP. Никотиновая кислота и ее амид в медицинской практике используются как лекарственные препараты, обладающие вазокардио-, гепато- и нейротропным действием. Недостаточное поступление никотиновой кислоты с пищей может привести к развитию пеллагры, проявляющейся характерной триадой симптомов: диарея, дерматит и деменция.
Никотиновой кислотой богаты продукты животного происхождения: печень, почки, сердце, телятина, говядина, мясо домашней птицы, рыба (лососевые, сельдь, треска). Из растительных продуктов ее содержат бобовые, арахис, грибы, картофель. Суточная потребность в никотиновой кислоте у детей - 10 - 20 мг.
Витамин В6(пиридоксин) необходим для процессов биосинтеза и переаминирования аминокислот, входит в состав ферментов декарбоксилаз и антианемического комплекса. Недостаточность пиридоксина способствует развитию гипохромной анемии, повышению возбудимости, возникновению желудочно-кишечных расстройств, задержке роста. Витамин В6 содержится в зародышах злаков, овощах, фруктах и многих продуктах животного происхождения. Потребность у детей - 1,0 - 2,0 мг в сутки.
Витамин В12(цианокобаламин) участвует в переносе метильных групп при синтезе метионина, нуклеиновых кислот и в обмене тетрагидрофолиевой кислоты; действует на гемопоэз. При недостатке в пище развивается мегалобластическая анемия. Цианокобаламин благоприятно влияет на функцию нервной системы и печени. В относительно больших количествах содержится в печени и почках крупного рогатого скота, печени рыб. Суточная потребность в витамине В12 у детей равна 0,5 - 2,0 мкг.
Витамин В15(пангамовая кислота) служит источником свободных метильных групп, оказывает липотропное действие в печени, обладает детокси-кационными свойствами. Как медикаментозный препарат пангамат кальция широко применяется в медицинской практике при зудящих дерматозах, интоксикации кортикостероидами и сульфаниламидами, хронических гепатитах, начальной стадии цирроза и др. Витамин В15 содержится во многих продуктах питания. Величина потребности организма в нем не выяснена.
Витамин С (противоскорбутный, аскорбиновая кислота) участвует в окислении аминокислот ароматического ряда (тирозина, фенилаланина), гидроксилировании пролина в оксипролин, способствует образованию проколлагена и переходу его в коллаген и т. д. Необходим для нормального процесса роста, способствует регенерации костной ткани, процессам свертывания крови, оказывает антитоксическое действие.
Недостаток витамина С у ребенка ведет к утомляемости, снижению аппетита, кровоточивости десен, иногда появлению точечных кровоизлияний на коже. Гиповитаминоз С вызывает развитие цинги (скорбута). Аскорбиновая кислота в больших количествах содержится в свежих продуктах растительного происхождения: капусте, салате, луке, черной смородине, шиповнике, картофеле и др., имеется также в молоке, яйцах. При кипячении витамин С разрушается. Суточное количество витамина для детей составляет 30 - 50 мг. При заболевании потребность в нем организма возрастает и дозу аскорбиновой кислоты независимо от возраста доводят до 300 - 500 мг в сутки.
Витамин Р (рутин, цитрин) усиливает действие витамина С, способствует восстановлению дегидроаскорбиновой кислоты в аскорбиновую. Широко применяется в педиатрической практике как лекарственное средство при токсических поражениях стенки капилляров, многих заболеваниях и отравлениях. Распространен в черной смородине, апельсинах, лимонах, перце, шиповнике, черноплодной рябине, малине, листьях чая и других продуктах. Суточная потребность у детей - 10 - 25 мг.
Антивитамины - химические соединения, оказывающие на организм действие, противоположное витаминам. При многих биохимических реакциях они находятся в конкурентных отношениях с витаминами. Став на место витамина, антивитамин делает фермент неактивным. К ним относятся также вещества, разрушающие или связывающие витамины. Антивитаминным действием обладают и некоторые противобактериальные препараты, например сульфаниламиды.
|
ПОИСК:
|
© ROGHDENIEREBENKA.RU, 2010-2019
При копировании материалов активная ссылка обязательна:
http://roghdenierebenka.ru/ 'Беременность, рождение и первые годы жизни ребёнка'
При копировании материалов активная ссылка обязательна:
http://roghdenierebenka.ru/ 'Беременность, рождение и первые годы жизни ребёнка'