
Глава V. Интенсивная терапия новорожденных близнецов
При многоплодии часто возникают осложнения беременности и родов. Помимо этого, второй плод, как правило, подвергается повышенной опасности асфиксии. В этой связи при многоплодной беременности являются актуальными вопросы реанимации и интенсивной терапии детей, родившихся в состоянии асфиксии, и оказания помощи недоношенным и с малой массой тела новорожденным.
Оказание помощи новорожденным начинают с отсасывания слизи из полости рта и носовых ходов в момент рождения головы ребенка стерильным эластичным катетером с помощью электроотсоса (манипуляция проводится у всех детей независимо от течения беременности и родов). Указанная процедура повторяется сразу же после рождения ребенка, до его отделения от матери. Отрицательное давление во время отсасывания слизи не должно превышать 200 - 260 гПа. В противном случае возможно возникновение ателектаза легких.
Оптимальный результат оценки состояния ребенка при рождении можно получить, использовав клинико-биохимические показатели, однако, учитывая безотлагательность реанимационных мероприятий, необходимо ориентироваться прежде всего на клинические критерии состояния новорожденного. Адекватную оценку тяжести перенесенной гипоксии и объема терапии можно получить с помощью шкалы Апгар: развернутую оценку состояния ребенка по шкале Апгар следует давать при его рождении (в конце 1-й минуты и через 5 мин после него).
На основании клинико-биохимических данных выделяют две степени тяжести гипоксии новорожденного, причем о тяжелой гипоксии свидетельствует не только оценка 4 балла и ниже, но и 5 - 6 баллов при рождении в случае отсутствия ее увеличения выше 7 баллов к 5-й минуте жизни. Повышение оценки до 8 - 10 баллов к 5-й минуте жизни даже при значительно низких величинах свидетельствует о легкой гипоксии.
При появлении у новорожденного клинических признаков дыхательной недостаточности необходимо оценить его респираторную функцию по шкале Сильвермана. Как известно, по этой шкале выраженному синдрому дыхательных расстройств соответствует оценка 10 баллов.
Важным моментом при оказании помощи новорожденному имеет предотвращение охлаждения ребенка. Спонтанная гипотермия обусловливает увеличение сопротивления сосудов легких и снижение активности сурфактанта, уменьшает степень оксигенации тканей, изменяет действие ряда препаратов. Учитывая вышеизложенное, следует принимать эффективные меры для сохранения исходной температуры тела новорожденного. В этих целях целесообразно использование столиков с подогревом.
При реанимации ребенка, родившегося в состоянии асфиксии, основной задачей является быстрое устранение гипоксии мозга и ее последствий путем установления у новорожденного адекватного спонтанного дыхания. Своевременная, целенаправленная и достаточно эффективная реанимация может быть осуществлена только при условии постоянной готовности персонала к оживлению новорожденных, родившихся в состоянии асфиксии.
Интервал между рождением ребенка и началом лечения последствий гипоксии не должен превышать 2 - 3 мин. Каждая минута, на которую откладывается начало эффективных мероприятий по обеспечению становления самопроизвольной функции дыхательного центра у новорожденного, находящегося в состоянии асфиксии, чревата опасностью тяжелых нарушений в центральной нервной системе. Следует отметить, что устройства для реанимации новорожденных с передвижным столом и дыхательный прибор позволяют сократить до минимума время начала проведения комплекса лечебных мероприятий (Л. Б. Маркин, 1982).
В основе механизма действия ряда методов лечения неспособности ребенка при рождении произвести первый вдох лежит рефлекторное возбуждение дыхательного центра, которое вызывают различными физическими и химическими средствами.
В некоторых случаях достаточно одной процедуры отсасывания аспирированных околоплодных вод из респираторных путей новорожденного, чтобы появились первые внеутробные дыхательные движения. Рефлекторное стимулирование дыхания у новорожденного осуществляют также с помощью обрызгивания его холодной водой.
Вопрос об использовании дыхательных аналептиков при лечении последствий внутриутробной гипоксии у новорожденных до настоящего времени остается нерешенным. Основным доводом, указывающим на недопустимость применения аналептиков, является риск быстрого истощения компенсаторно-защитных реакций после кратковременной их стимуляции. Вместе с тем следует отметить, что полный отказ от применения дыхательных аналептиков при лечении гипоксических состояний новорожденных, так же как и осуществление стимулирующей терапии с помощью только этих средств, является недостаточно обоснованным. Очевидно, использовать для терапии тяжелых расстройств дыхания у новорожденных такие препараты, как лобелии и цититон, не следует, но это не исключает возможности включения в комплекс лечебных мероприятий аналептиков центрального действия, к которым относится препарат этимизол. В противоположность другим аналептикам этимизол оказывает избирательное действие на дыхательный центр, в первую очередь на нервные клетки ретикулярной формации ствола мозга, участвующие в регуляции дыхания, способствует включению гиповентилируемых участков легкого в газообмен. Используют 0,3 % раствор этимизола из расчета 0,1 - 0,3 мг/кг массы тела новорожденного.
Ведущим методом лечения нарушений становления внешнего дыхания у новорожденных является искусственная вентиляция легких (ИВЛ). Показаниями к ИВЛ являются отсутствие самостоятельного вдоха у ребенка после рождения в течение 1 мин, не установившееся регулярное дыхание и другие клинические признаки гипоксии (оценка по шкале Апгар 6 баллов и ниже). При этом новорожденного переносят на реанимационный столик, проводят санацию трахеобронхиального дерева под контролем прямой ларингоскопии, осуществляют также отсасывание содержимого из желудка.
В настоящее время для искусственной вентиляции легких у новорожденных с различными расстройствами дыхания в первые минуты жизни используют масочный и интубационный методы. Принцип ИВЛ с помощью маски заключается в том, что вдувание газовой смеси в легкие новорожденного производят при помощи носо-губной маски с резиновым надувным обтуратором, соединенной с источником кислородно-воздушной смеси. Наложение маски на лицо ребенка приводит к неизбежному увеличению вредного пространства и некоторому снижению величины вентиляции легких. Поэтому у новорожденных необходимо использовать маски самых малых размеров.
Более эффективную вентиляцию легких осуществляют путем введения кислорода через интубационную трубку. Интубация трахеи является основным методом обеспечения свободной проходимости дыхательных путей при проведении управляемой вентиляции легких. Интубацию трахеи новорожденного производят по следующим показаниям: клиническая смерть, при которой выполняют длительные мероприятия по оживлению ребенка, вплоть до прямого массажа сердца; тяжелая степень асфиксии, массивная аспирация околоплодных вод, слизи, мекония, сгустков крови и других корпускулярных частиц; недостаточная эффективность вентиляции через маску в течение 4 - 5 мин.
Интубация трахеи у новорожденного не представляет трудностей при правильном положении головы ребенка. Интубационные трубки должны быть изготовлены из резины или пластических масс. Использование металлических интубационных трубок недопустимо. Желательно однократное применение катетеров для отсасывания слизи и интубационных трубок, так как при стерилизации они становятся более жесткими и травмируют трахею, а также являются источником инфекции. Для новорожденных с массой тела до 1000 г используют интубационные трубки диаметром 2 мм, 1001 - 2000 г - 2,5 мм, 2001 - 3000 г - 3 мм, более 3000 г - 3,5 мм.
Обычно для ИВЛ используется 40 - 60 % кислородно- воздушная смесь, так как ингаляция чистого кислорода опасна, особенно для новорожденных с малой массой тела при транссудации и экссудации в легких, нарушении липидной стромы эритроцитов, изменении клеток в центральной нервной системе, ретролентальной фиброплазии, повреждении сетчатки и др. Управление дыханием осуществляют по его частоте (25 - 30 мин), объему (25 - 30 мл) и давлению (2,0 - 2,9 кПа). Оптимальным соотношением времени вдоха и выдоха является Г:1, 5 - 1:2.
Необходимо стремиться к максимальному уменьшению давления, обеспечивающему адекватный уровень альвеолярной вентиляции. Эффективна перемежающаяся ИВЛ при частоте дыхания с редкими циклами (10 - 40 в 1 мин), длительным вдохом (0,8 - 1,2 с), относительно низким давлением на вдохе (менее 200 Па) и высоким временным соотношением вдох - выдох (сначала около 1). Г. К. Степанковская и А. С. Лявинец (1984) указывают на успешное проведение недоношенным детям ИВЛ малыми объемами (5 - 8 мл3) при высокой частоте дыхания (60 - 80 в 1 мин).
При ИВЛ любой продолжительности вдыхаемую газовую смесь рекомендуют увлажнять и обогревать. В противном случае нарушается водный баланс, высушивается слизистая оболочка трахеи и бронхов, что приводит к деструкции реснитчатого эпителия. Включение в магистраль вдоха специального ультразвукового распылителя аэрозолей дает возможность не только достичь увлажнения смеси газов, но и ввести в нее лекарственные препараты. При использовании протеолитических ферментов (химотрипсина, ацетилцистеина), антибиотиков и кортикостероидов можно добиться разжижения содержимого трахеобронхиального дерева, антибактериального эффекта.
В результате любого способа искусственной вентиляции необходимо внимательно следить за началом регулярных спонтанных дыхательных движений. После их появления следует перейти на вспомогательную вентиляцию легких, которая заключается в искусственном увеличении собственного вдоха новорожденного. Искусственную вентиляцию легких можно прекратить после стойкого установления адекватного дыхания у новорожденного и устранения явлений кислородной недостаточности (кожные покровы розовые, рефлексы живые, низкие рСO2).
Вопрос о продолжительности управляемой ИВЛ в случае отсутствия эффекта должен решаться строго индивидуально и консультативно (акушером совместно с анестезиологом и неонатологом). Если в течение 20 - 25 мин проведения ИВЛ самостоятельное дыхание не устанавливается, то ближайший и отдаленный прогноз для ребенка ухудшается и жизнеспособность его сомнительна.
Способствует быстрому расправлению легких, предупреждает развитие вторичных ателектазов проведение ИЛВ с помощью гелий-кислородной смеси (3:1,2:1,1:1). Гелий, ввиду своей низкой плотности, обладает высокой диффузионной способностью, легко проходит через узкие дыхательные пути новорожденного, перенося с собой кислород.
Помимо ИВЛ в лечении дыхательных расстройств при гипоксических состояниях новорожденных с успехом применяют гипербарическую оксигенацию. При этом ребенка помещают в барокамеру, в течение 10 мин повышают (до 147 кПа) давление и поддерживают его на таком уровне в течение 5 мин. Затем постепенно в течение 15 мин снижают до 29,5 - 49 кПа и сохраняют на таком уровне от 30 мин до 2 - 3 ч.
В условиях гипербарической оксигенации насыщение крови кислородом происходит чрезвычайно быстро. При этом кислород усиленно диффундирует через слизистую оболочку верхних дыхательных путей и, возможно, через кожу в кровь. Активация тонуса дыхательного центра при гипербарической оксигенации обусловлена повышением содержания кислорода в крови, раздражением рецепторов сосудов легких и кожи.
Осуществление лечебных мероприятий в целях улучшения газообмена необходимо сочетать с введением лекарственных препаратов в вену пуповины. Малые количества жидкости вводят в вену пуповины путем ее пункции. При показаниях к вливанию большого количества жидкости производят катетеризацию вены пуповины полиэтиленовым катетером при строгом соблюдении правил асептики и антисептики. Герметизацию катетера обеспечивают съемной канюлей.
Для коррекции метаболических нарушений применяют растворы натрия гидрокарбоната, натрия лекарства или трисамина (ТНАМ). При наличии возможности дефицит оснований следует определить с помощью микро-анализатора. При отсутствии данных показателя BE 4 % раствор натрия гидрокарбоната вводят из расчета 25 мг/кг массы тела новорожденного. В случае выраженного ацидоза рекомендуют применять 0,3 М раствора трисамина в количестве 2 - 3 мл. Введение щелочных растворов целесоообразно сочетать с вливанием 20 % раствора глюкозы (5 мг/кг).
Для улучшения сердечной деятельности показано введение кокарбоксилазы (8 - 10 мг/кг). При наличии брадикардин (пульс менее 80 в 1 мин) следует внутривенно применить кальция глюконат (2 - 3 мл 10 % раствора).
Легкие как орган газообмена являются сосудистыми образованиями. Полноценное устранение ателектаза возможно лишь при условии достаточного кровенаполнения и нормального хода расправления всех сосудов легких, в том числе и капилляров (И. К. Есипова, О. Я. Кауфман, 1968).
При гиноксическом состоянии новорожденного, как с правило, наблюдается резкое повышение сопротивления кровотоку дистальных отделов легочной артерии. Это обусловлено тем, что мелкие внутрилегочные артерии новорожденного недостаточно дифференцированы, отличаются преобладанием неисчерченных мышечных элементов в сосудистой стенке, особой предрасположенностью к спазму, способностью реагировать сужением просвета на гипоксемию и изменение химизма циркулирующей крови. Активное сокращение периферических сосудов мышечного типа ограничивает гемодинамику в малом круге кровообращения, нарушает постнатальную перестройку легких, становление адекватного газообмена (Л. Б. Маркин, Е. В. Святоцкая, 1984).
Изложенное свидетельствует о целесообразности применения при дыхательной реанимации новорожденных, находящихся в состоянии кислородной задолженности, средств, блокирующих прессорную реакцию прекапил- лярного русла легких, обеспечивающих раскрытие дистальных отделов легочной артерии, способствующих содружественному расправлению сосудистой системы и респираторных каналов.
Весьма эффективным является применение у новорожденных в целях коррекции нарушений перестройки малого круга кровообращения в ранний постнатальный период препаратов, оказывающих прямое миотропное спазмолитическое действие, в частности галидора (1 мг/кг) (Л. Б. Маркин, 1975).
В целях устранения отека мозга, стимуляции дыхательного центра, улучшения кровотока через систему легочных сосудов Г. К. Степанковская и соавторы (1978) рекомендуют вводить в вену пуповины по 3 - 5 мг 2,4 % раствора эуфиллина.
Более быстрая стимуляция функции дыхания, стойкое улучшение сердечной деятельности наблюдаются у детей, родившихся в состоянии асфиксии, в результате применения гидрокортизона (5 мг/кг).
В ранний неонатальный период у новорожденных, перенесших внутриутробную гипоксию, должен осуществляться контроль за показателями КОС, рО2 и рСО2 крови, гемоглобина, гематокритного числа, глюкозы, электролитов. Целесообразно широко использовать мониторные системы, позволяющие контролировать частоту сердечных сокращений и дыхания, регистрировать апноэ различной продолжительности, возникновение тахикардии и брадикардии.
В постреанимационный период в организме новорожденного отмечают значительные нарушения обменных процессов, сопровождающихся развитием метаболического ацидоза, изменением водно-солевого баланса и расстройством гемодинамики. Наблюдается гипогликемия, одной из причин которой является недостаток в организме ребенка кислорода, участвующего в процессе анаэробного гликолиза, и низкая продукция энергии. Это приводит к большому расходу гликогена и глюкозы и накоплению лактата. При недостатке глюкозы в качестве энергетических продуктов используют жиры и белки. Усиленный липолиз сопровождается увеличением в крови концентрации свободных жирных кислот и накоплением кетоновых тел.
Накопление кислых продуктов обмена приводит к спазму сосудов почек, что в сочетании с низким артериальным давлением проявляется значительным нарушением почечного плазмотока и резким снижением диуреза.
Существенные изменения при асфиксии новорожденных происходят в балансе калия. Усиление анаэробных процессов распада веществ ведет к снижению образования АТФ, вследствие чего клетки не усваивают калий и его уровень в сыворотке крови повышается. Клетки, теряя калий, обогащаются натрием, что ведет к снижению концентрации последнего во внеклеточной жидкости. Переход ионов натрия в клетки сопровождается накоплением в них воды и развитием внутриклеточного отека.
Кислородная недостаточность приводит к выраженным изменениям гемодинамики. У большинства новорожденных развивается гиповолемия за счет перемещения жидкой части плазмы крови в экстраваскулярное пространство.
Недостаток кислорода, нарушение тканевого дыхания, накопление кислых продуктов обмена вызывают расстройства микроциркуляции. Изменяются реологические свойства крови: увеличивается ее вязкость, наблюдается повышенная агрегация эритроцитов и сгущение крови за счет выхода ее жидкой части в экстраваскулярное пространство, что способствует развитию интерстициального или тканевого отека.
Увеличивается проницаемость сосудистых стенок, которая приводит к выходу из сосудистого русла не только жидкой части крови, но и эритроцитов по типу диапедезного кровоизлияния. Замедляется кровоток, что ведет к стазу крови, запустеванию части капилляров и появлению ишемических участков в тканях и органах (М. В. Федорова, Г. Ф. Быкова, 1982).
Последствия внутриутробной гипоксии затрудняют процесс постнатальной адаптации новорожденного, обусловливают необходимость проведения дифференцированных лечебно-реабилитационных мероприятий.
В целях коррекции тканей гипоксии целесообразно с момента рождения и на протяжении раннего неонатального периода использовать 0,25 % раствор цитохрома С, который вводят внутримышечно по 4 мл 1 раз в сутки.
Новорожденным детям, перенесшим гипоксию, назначают также а-токоферол. Это обусловлено нарушением усвоения витамина Е при гипоксии; его участием в процессах тканевого дыхания (стимулирует синтез цитохрома) в связи с выраженным антиоксидантным эффектом. Токоферола ацетат назначают энтерально или парентерально в виде 5 % раствора из расчета 10 - 15 мг в сутки.
Основными задачами инфузионной терапии является: нормализация гемодинамики, водно-электролитного баланса и кислотно-основного состояния, обеспечение диуреза, имеющего важное значение для поддержания гомеостаза, доставка энергетического и пластического материала (Е. Е. Бадюк, Ю. А. Тылькиджи, 1983).
Инфузионную терапию следует начинать через несколько часов после рождения. Введение жидкости необходимо проводить только капельно, со скоростью не более 8 капель в 1 мин. Форсированное вливание (15 - 25 капель в 1 мин) допустимо лишь при резком обезвоживании организма и в течение непродолжительного времени (20 - 30 мин).
Глюкозу применяют в виде 10 или 20 % раствора в количестве 10 мл на 1 кг массы тела. Она является незаменимым энергетическим продуктом, уменьшающим гиперкатаболизм тканей у новорожденных, предотвращающим развитие кетоза. Глюкозу следует сочетать с введением адекватного количества инсулина (1 ЕД на 3 - 4 г сухого вещества глюкозы). Инсулин способствует отложению гликогена в печени, увеличивает скорость прохождения глюкозы через клеточные мембраны, стимулирует процессы окислительного фосфорилирования. Кроме того, инсулин способствует переходу калия из внеклеточного пространства в клетку.
Глюкозу можно применять в сочетании с другими сахарами или сахароподобными веществами - фруктозой, ксилитом. Фруктоза утилизируется почти исключительно в печени, не требует инсулярной активности, что делает ее ценным источником энергии при пониженной функции поджелудочной железы. Ксилит обладает мощным анти- кетогенным действием. Скорость введения фруктозы не должна превышать 0,25 г/кг/ч, ксилита - 0,125 г/кг/ч. Считают благоприятным сочетание глюкозы, ксилита и фруктозы. При этом общее количество фруктозы не должно превышать 0,25 г/кг/ч.
Для улучшения микроциркуляции, предотвращения агрегации эритроцитов, профилактики коагулопатии применяют низкомолекулярные декстраны - 10 % растворы реополиглюкина или реомакродекса по 10 мл на 1 кг массы тела.
При проведении инфузионной терапии целесообразно вводить внутривенно аскорбиновую кислоту в дозе до 100 мг в сутки. В дальнейшем показано ее применение внутрь в течение раннего неонатального периода - по 50 мг 3 раза в день в порошке, содержащем также 26 мг рутина, который облегчает транспорт и депонирование аскорбиновой кислоты.
Применяя гемодилютанты, необходимо тщательно следить за показателями гемодинамики, контролировать ОЦК, показатели метаболизма, водно-электролитное состояние. Следует иметь в виду, что инфузия реомакродекса или реополиглюкина приводит к уменьшению степени ацидоза, поэтому доза применяемых щелочных растройств должна быть снижена наполовину. Процесс гемодилюции подразумевает также адекватное выведение жидкости из организма ребенка.
Чтобы повысить онкотическое давление плазмы, применяют 20% раствор альбумина (5 - 10 мл на 1 кг массы тела), в этих же целях можно использовать концентрированную плазму.
Для дегидратации ткани головного мозга у новорожденных, перенесших тяжелую гипоксию, можно применять раствор сорбита. Наряду со снижением внутричерепного давления, сорбит способствует улучшению мозгового кровообращения и нормализации потребления кислорода тканью головного мозга. Сорбит активно участвует в обмене веществ. В клетках печени под действием сорбитдегидрогеназы он превращается во фруктозу. Таким образом, применение раствора сорбита способствует увеличению онкотического давления, объема циркулирующей крови и перфузионного давления мозга. Кроме того, сорбит обеспечивает дегидратацию ткани головного мозга и частично покрывает энергетические потребности организма. Детям, перенесшим тяжелую гипоксию, инфузию сорбита проводят в объеме 15 мг/кг в сутки (по 4 - 5 капель в 1 мин) в течение первых 2 дней жизни.
К числу осмотически активных веществ относится маннит, который способен снижать внутричерепное давление и величину гематокритного числа, повышать почечный кровоток. Маннит вводят обычно в виде 10 % раствора в количестве 7 - 10 мл на 1 кг массы тела. Осмотический и диуретическийй эффект маннита объясняют повышением осмотического давления внутри просвета почечных канальцев и уменьшением реабсорбции жидкости в проксимальных канальцах. Диурез сопровождается значительной экскрецией натрия без существенного воздействия на выделение калия.
В качестве диуретического средства с хорошим эффектом можно применять лазикс. Его назначают по 1 - 2 мг на 1 кг массы тела 2 раза в сутки. Диуретический эффект, оказываемый лазиксом, связан с угнетением ре-абсорбции ионов натрия и хлора не только в проксимальных, но и в дистальных участках извитых канальцев почек.
Хорошее диуретическое действие у доношенных новорожденных производит эуфиллин. Этот препарат применяют у детей с дыхательной недостаточностью, что обусловлено его способностью улучшать бронхиальную проходимость и снижать сопротивление сосудов малого круга кровообращения. Кроме того, особенности метаболизма эуфиллина у новорожденных определяют возможность его стимулирующего действия на дыхательный центр. У новорожденных эуфиллин используют в виде 2,4 % раствора из расчета 0,2 мг/кг на прием (внутримышечно или внутривенно) 2 - 3 раза в сутки.
В целях нормализации баланса электролитов (соотношений калий/кальций, калий/натрий) следует вводить 10 % раствор кальция глюконата из расчета 1 мл на 1 кг массы тела. Для коррекции проявлений метаболического ацидоза применяют натрия гидрокарбонат и глутаминовую кислоту (до 8 - 9-го дня жизни). При клинических признаках нарушения функции надпочечников рекомендуют назначать стероидные препараты (гидрокортизон - по 5 - 10 мг/кг/сут, преднизолон - по 1 - 3 мг/кг/сут) в течение 5 - 7 сут.
Дефицит витамина К принято возмещать в течение первых 3 сут жизни, то есть до тех пор, пока у ребенка не нормализуется синтез витамина К. Профилактическую дозу викасола - 1 мг/кг - следует назначать при легкой перинатальной гипоксии. При наличии тяжелой гипоксии или подозрении на внутричерепное кровоизлияние эту дозу необходимо утроить. Викасол назначают либо в порошках, либо в виде 1 % раствора внутримышечно.
Для нормализации нейродинамических процессов назначают лечебно-охранительный режим. При наличии признаков повышенной возбудимости ЦНС назначают 20 % раствор ГОМК из расчета 100 - 150 мг на 1 кг массы тела. При возникновении судорожного синдрома, кроме ГОМК, показано внутримышечное введение 0,25 % раствора аминазина по 1 -1,5 мл и 25 % раствора магния сульфата - 1 - 2 мл. Хорошим противосудорожным свойством обладает дроперидол, который вводят парентерально в виде 0,25 % раствора из расчета 0,1 мг/кг на прием. Дроперидол нормализует периферическое кровообращение, ликвидирует гипоксию тканей.
При выраженном нарушении мозгового кровообращения применяют краниоцеребральную гипотермию, которая снижает потребность мозга в кислороде, устраняет отек мозговой ткани, снижает обменные процессы в тканях, предупреждает развитие необратимых постгипоксических изменений и повреждений ЦНС.
Охлаждение головки новорожденного производится разными способами. Наиболее простым является орошение волосистой части головки новорожденного холодной водой (температура 8 - 10°С). Более эффективно применение шлема из каучуковых или металлических трубок, по которым циркулирует вода (температура 4 - 6°С), охлажденный воздух или жидкий азот. Контроль за температурой осуществляют через каждые 15 мин. Для этого в слуховой проход и прямую кишку вставляют электротермометр с двумя электродами. Оптимальным условием краниоцеребральной гипотермии служат снижение частоты сокращений сердца новорожденного до 60 - 80 в 1 мин, частоты дыхания - до 20 в 1 мин. Перед проведением краниоцеребральной гипотермии обязательным является проведение премедикации (1 - 2 мл 20 % раствора ГОМК, 0,8 мл 0,25% раствора дроперидола). Это обусловлено тем, что охлаждение организма может привести к возбуждению, появлению дрожи, усилению теплопродукции и другим вегетативным реакциям.
В целях улучшения функции внешнего дыхания используют масочное дыхание увлажненным кислородом до и после кормления по 5 - 10 мин, ингаляции гелий- кислородной смеси в соотношении 1:1 3 - 4 раза в 1 сут, назначают также аналептические средства (этимизол - по 0,2 мл, кордиамин - по 0,3 мл).
К определению сроков прикладывания к груди детей, родившихся в асфиксии, подходят индивидуально, в зависимости от их состояния.
При осложнении многоплодной беременности преждевременными родами необходимо в полном объеме оказать помощь недоношенным новорожденным.
При оценке степени зрелости и доношенности близнецов их небольшая масса не является определяющим фактором.
Поэтому для оценки физиологического состояния новорожденных при многоплодии, помимо антропометрических данных, необходимо учитывать основные отправления физиологических функций организма.
Морфологическая и функциональная незрелость недоношенных детей предопределяет ряд особенностей их реанимации и интенсивной терапии (А. Г. Антонов и соавт., 1987).
В родильном зале, где происходят преждевременные роды, необходимо по возможности обеспечить комфортные для недоношенного ребенка условия: температура воздуха должна быть в пределах 25 - 28°С при относительной влажности 50 %.
Недоношенные дети по характеру своей терморегуляции приближаются к пойкилотермным организмам (то есть температура их тела зависит от температуры окружающей среды). Они легко перегреваются и переохлаждаются. Оптимальным температурным режимом считается тот, при котором ребенок сохраняет постоянную температуру тела при наименьшем напряжении терморегуляции.
Важным критерием правильного теплового режима является постоянная температура тела выше 36°С с колебаниями в течение суток не более 0,4 - 0,8°С.
Предупреждает у новорожденного развитие состояния гиповолемии, обеспечивает оптимальное гематокритное число, повышает сердечный выброс, усиливает перфузию легких, облегчает адаптацию недоношенного ребенка к внеутробным условиям существования длительная плацентарная перфузия (отсроченная до 3 мин перевязка пуповины второго плода).
После отсасывания содержимого из полости рта, носоглотки и желудка кожу новорожденного следует осушить сухой стерильной согретой салфеткой и поместить его в кувез, в котором осуществить все последующие мероприятия.
При удовлетворительном состоянии новорожденного в вену пуповины вводят 10 % раствор глюкозы из расчета 5 мл/кг и кокарбоксилазу - 8 мг/кг массы тела.
Наличие поверхностного, неадекватного дыхания является показанием для проведения вспомогательной вентиляции легких масочным способом кислородно-воздушной смесью, содержащей 60 % кислорода (в течение 30 - 60 с, в ритме дыхания 30 - 40 в 1 мин). При этом в сосуды пуповины вводят 10 % раствор глюкозы из расчета 5 мл/кг и кокарбоксилазу - 8 мг/кг, а при гипотонии - дополнительно гидрокортизон - 5 мг/кг - или преднизолон - 1 мг/кг.
При рождении недоношенного ребенка в тяжелом состоянии вспомогательную вентиляцию легких проводят в указанном выше режиме до появления регулярного самостоятельного дыхания. Одновременно в вену пуповины вводят раствор глюкозы, кокарбоксилазу и глюкокортикоидные препараты. Повторно отсасывают содержимое полости рта и носоглотки. При отсутствии спонтанного дыхания в течение 2 - 3 мин под контролем прямой ларингоскопии производят интубацию трахеи, отсасывают содержимое из трахеи и главных бронхов и приступают к аппаратной ИВЛ (максимальное давление на вдохе 2 - 2,5 гПа, дыхательный объем соответствует удвоенной массе тела, умноженной на 6, частота дыхания 30 - 40 в 1 мин, соотношение вдох - выдох 1 : 2, концентрация кислорода 60 %).
При адекватной вентиляции легких применяют 4 % раствор натрия гидрокарбоната из расчета 2,5 мл/кг массы тела. При брадикардии менее 80 в 1 мин наряду с наружным массажем сердца в вену пуповины вводят 10 % раствор глюконата кальция в количестве 2 - 3 мл. В случае остановки сердца в вену пуповины дополнительно вводят 0,1 мл 0,1 % раствора адреналина гидрохлорида, 1,5 - 2 мл 10 % раствора глюконата кальция, а также преднизолон или гидрокортизон в указанных выше дозах. При неэффективности проводимой терапии внутрисердечно вводят 0,1 мл 0,1 % раствора адреналина гидрохлорида.
При эффективности указанных выше мероприятий ребенка в кувезе перевозят в палату интенсивной терапии новорожденных.
Все недоношенные дети подлежат выхаживанию в кувезах. Относительная влажность воздуха в кувезе в первые дни жизни должна составлять 90 - 95 %, а к концу первой недели жизни - 65 - 70 %. Для плодов с массой тела менее 1000 г температура воздуха в инкубаторе в первые 10 дней жизни должна составлять 36°С, с 11-го по 20-й день - 35°С, с 21-го дня до 1 мес - 34°С и после 1 мес - 33 - 32°С; для недоношенных детей с массой тела от 1000 до 1500 г в первые 10 дней - 35°С, с 11-го г до 20-го дня - 34°С, с 21-го дня до 1 мес - 33°С и после 1 мес - 32°С; для новорожденных с массой тела от 1500 до 2000 г в первые 10 дней - 34°С, с 11-го до 20-го дня - 33°С и после 1 мес - 32°С; для недоношенных с массой тела от 2000 до 2500 г в первые 2 дня жизни - 340°С, с 3-го до 20-го дня - 330°С, после 20-го дня жизни - 32°С.
Во время пребывания ребенка в палате для недоношенных детей исключительно важно проводить мониторный контроль за состоянием его сердечно-сосудистой системы и респираторной функции. Для этого целесообразно использовать отечественный педиатрический монитор МП-01. В целях своевременной коррекции нарушений гомеостаза необходимо проводить лабораторные исследования крови для определения гемоглобина, гемато-критного числа, КОС, общего белка и его фракций, глюкозы мочевины, калия, натрия и кальция, времени свертывания крови.
Сравнительно новым и эффективным методом интенсивной терапии недоношенных новорожденных является спонтанное дыхание под постоянным положительным давлением в дыхательных путях (СДППД). Небольшое повышение внутрилегочного давления предотвращает экспираторное закрытие дыхательных путей, компенсируя сниженный уровень сурфактанта. При этом происходит расправление гиповентилируемых и спавшихся альвеол, увеличиваются сниженная функциональная остаточная емкость и объем легких, улучшается вентиляционно-перфузионное состояние, снижается внутрилегочное венозно-артериальное шунтирование.
Положительное давление в дыхательных путях может быть достигнуто различными способами, например способом Грегори. Его принцип заключается в том, что к эндотрахеальной трубке, проведенной через нос, подключают четырехходовой коннектор, соединенный с резиновым мешком, имеющим выходное отверстие, перекрытое зажимом Мора. К коннектору подводят 2 трубки: одну - для притока кислородно-воздушной смеси, другую - для соединения с манометром и водным клапаном. Дыхательную смесь подают в систему через ротаметры наркозного аппарата. Для того чтобы предотвратить гиперкапнию, газовый поток должен в 3 - 4 раза превышать минутный объем дыхания ребенка. Регулируя зажимом Мора выход газа из мешка, устанавливают необходимое давление в дыхательных путях, контролируя его по манометру. Если давление в системе возрастает более установленной величины, избыточный газ сбрасывается через водный клапан.
Одним из наиболее распространенных способов создания положительного давления в дыхательных путях, не требующих интубации трахеи, является способ Мартина - Буйера. На голову ребенка надевают полиэтиленовый мешок, в котором создают избыточное давление кислорода. Для этого величину мешка выбирают с таким расчетом, чтобы при раздувании между его стенками и лицом оставалось пространство 5 - 6 см. Это предотвращает образование в мешке плохо вентилируемых участков и позволяет сохранять подвижность головы во время проведения сеанса. Предварительно толстой иглой в мешке прокалывают 2 отверстия, в которые вводят резиновые трубки. Для герметичной фиксации необходимо, чтобы их наружный диаметр был на 2 - 3 мм больше отверстия в мешке. Одну трубку соединяют с источником газовой смеси, другую - с водным манометром, в качестве которого используют банку Боброва. Высота воздушного столба, вытеснившего воду, указывает на давление в системе. Газовую смесь подают так же, как и при способе Грегори. Мешок надевают на голову и поролоновой лентой не очень плотно герметизируют на шее. Лучше использовать ленту шириной 4 - 5 см, так как она не скручивается, создает удовлетворительную герметизацию и не беспокоит ребенка.
Положительное давление в дыхательных путях можно также создать с помощью лицевой маски. В простейшем случае для этого может быть использована маятниковая система наркозного аппарата, соединенная с источником газовой смеси и манометром. Однако при применении лицевой маски часто бывает очень трудно добиться герметичности системы, слишком плотное прижатие маски быстро приводит к мацерации эпителия.
На наш взгляд, более безопасным для поддержания постоянного положительного давления в дыхательных путях новорожденного является использование интраназальных канюль. Установлено, что новорожденный дышит преимущественно носом и держит рот закрытым до тех пор, пока интраназальное давление не превысит 100 - 120 Па. При проведении спонтанного дыхания под постоянным положительным давлением в ноздри ребенка вводят две тонкие короткие трубочки, а более толстую трубку прижимают к ноздрям и закрывают их с помощью широкого тонкого резинового ремешка. В один конец толстой трубки по шлангу подают дыхательную газовую смесь, поступающую дальше через канюли в дыхательные пути и создающую в них повышенное давление. От другого конца толстой трубки идет шланг к банке Боброва. Вся система снабжена тонкостенным резиновым мешком, служащим резервной емкостью для вдоха. Избыток воздуха из системы выходит частично из носа (отталкивая прижатую толстую трубку), а частично - через банку Боброва.
Показанием к СДППД является снижение напряжения кислорода в крови ниже 80 гПа при вдыхании 60 % кислорода. При этом напряжение углекислоты в крови также не должно превышать. 80 гПа. Резерв в. улучшении оксигенации организма заключается, с одной стороны, в повышении давления до 0,5 - 0,7 гПа, а с другой - в увеличении концентрации вдыхаемого кислорода. При нормализации газов крови и показателей КОС через каждые 2 ч сопротивление на выдохе следует уменьшать па 0,2 - 0,3 гПа, а затем перейти на оксигенацию через носовой катетер.
Ингаляционную терапию проводят в целях улучшения дренажной функции легких, разжижения патологического содержимого, уменьшения бронхоспазма, дополнительного введения лекарственных веществ. Успех ингаляции зависит как от правильного выбора состава аэрозоля, так и от степени дисперсности лекарственных веществ, проникновение которых в дыхательные пути обусловлено величиной распыляемых частиц. Оптимальным методом проведения аэрозольной терапии является использование ультразвуковых ингаляторов, которые позволяют распылять частицы диаметром 1 - 5 мкм. Хороший эффект дает использование для ингаляций 2 % раствора натрия хлорида, 3 % раствора натрия гидрокарбоната, 0,1 % раствора трипсина, 0,1 % раствора химотрипсина, 0,3 % раствора панкреатина.
Оптимальное количество парентерально вводимой жидкости составляет 70-80 мл/кг для детей с массой тела до 1500 г и 80 - 100 мл/кг более 1500 г. Суммарный объем вводимой жидкости не должен превышать суточной потери жидкости ребенком с учетом диуреза и внепочечной потери.
Соотношение коллоидных и кристаллоидных растворов 1:1 или 1:2. Наряду с гемодилюцией необходимо вводить средства, усиливающие диурез. Наиболее выраженный эффект дает лазикс, который применяют в дозе 1 - 3 мг/кг в сутки.
Коррекция гипогликемии (концентрация глюкозы в крови менее 1,7 ммоль/л) начинается с внутривенного вливания 20 % раствора глюкозы (2 - 4 мл/кг) со скоростью 1 мл/мин. По мере ликвидации гипогликемии концентрация раствора глюкозы уменьшается сначала до 10%, а затем (при уровне глюкозы в крови не ниже 2,8 ммоль/л) - до 5%. На каждые 100 мл вводимого раствора глюкозы следует добавлять 2 мл 10 % раствора кальция глюконата и 1,5 ммоль натрия хлорида.
Благоприятное влияние на тканевое дыхание оказывает кокарбоксилаза. Недоношенным новорожденным показано введение кокарбоксилазы из расчета 8 - 10 мг на 1 кг массы тела. В инфузионные среды целесообразно также добавлять 2 - 4 мл 5 % раствора аскорбиновой кислоты и 0,5 мл АТФ. Учитывая благоприятное воздействие кортикостероидов на деятельность сердечно-сосудистой системы, недоношенным новорожденным следует вводить преднизолон.
При возникновении сердечной недостаточности назначают сердечные гликозиды (0,05 % раствор строфантина или 0,06 % раствор коргликона из расчета 0,01 или 0,02 мл/кг от 1 до 3 раз в сутки). Дигоксин назначают 0,05 мг/кг 3 раза в сутки.
Одновременно с инфузионной терапией целесообразно проводить коррекцию обменных нарушений. Прежде всего, речь идет о коррекции нарушений КОС, среди которых доминирующим является ацидоз. Для коррекции метаболического ацидоза количество 5% раствора натрия гидрокарбоната в миллилитрах рассчитывают по формуле:
| ВЕ · массу тела (кг) | . | |
| 4 |
Исключительно важно при проведении интенсивной терапии обеспечивать недоношенных детей достаточным питанием. Первое кормление грудным молоком при неврологических и дыхательных нарушениях, при сердечно-сосудистой недостаточности недоношенным детям назначают через 12 - 24 ч. Однако еще до начала кормления потребность в жидкости удовлетворяют путем введения лечебных растворов парентерально капельно или через желудочный зонд в объеме 5 % массы тела. При невозможности введения жидкости в желудок (парез пищеварительного канала) решают вопрос о проведении парентерального питания. В 1-е сутки жизни недоношенный ребенок должен получить 42 -84 кДж, на 2-е - 105 кДж, на 3-й - 126 кДж, на 4-е - 167 кДж, на 7-е - 293 кДж, на 10-е - 335 - 419 кДж, на 20-е - 502 кДж. Следует отметить, что при парентеральном введении препаратов нужно учитывать потребности ребенка не только в энергии, но и в жидкости. Потребность в жидкости в среднем составляет в 1 - 2-е сутки 30 - 40 мл/кг, 4 - 7-е сутки - 80 - 100 мл/кг, далее до 1 мес - 150 мл/кг.
Источником углеводов для парентерального питания является глюкоза (10 - 20% раствор), аминокислот - белковые гидролизаты (аминон, аминазол) и растворы кристаллических аминокислот (полиамин, аминостерил) в дозе от 0,5 до 2,5 сухого вещества на 1 кг массы тела. В качестве источника жира используют жировые эмульсии (липофундин С, интралипид, липозин) в дозе 0,5 - 2 г вещества на 1 кг массы тела (А. Г. Антонов и соавт., 1987).
Непременным условием интенсивной терапии недоношенных детей является соблюдение принципов асептики и антисептики. Несмотря на это, именно в отделениях интенсивной терапии, где сосредоточено много недоношенных детей, чаще всего формируются госпитательные штаммы микроорганизмов. В настоящее время наряду со строгим соблюдением санитарно-гигиенического режима и правильным подходом к применению антибиотиков необходимо заселять организм недоношенных детей бифидофлорой (бифидумбактерин по 5 доз 2 - 3 раза в сутки через рот).
В заключение следует отметить, что в деле снижения перинатальной заболеваемости и смертности при многоплодии, помимо рационального ведения беременности и родов, существенное значение имеет своевременное проведение реанимационных мероприятий при рождении ребенка в состоянии асфиксии и оказание квалифицированной помощи недоношенным новорожденным. Последнее предполагает совершенствование организации службы интенсивной терапии в родовспомогательных учреждениях, широкое внедрение в клиническую практику надежных методов коррекции расстройств постнатальной адаптации новорожденных.
* * *
Большая частота нарушения развития плодов-близнецов, осложнений беременности, родов и послеродового периода позволяет считать наличие многоплодия у женщин фактором высокого риска по возникновению материнской, перинатальной заболеваемости и смертности. Анализ данных литературы и собственных исследований дает возможность отнести многоплодную беременность к разделам патологического акушерства.
В реализации лечебно-профилактических мероприятий по улучшению качества родовспоможения у данной группы женщин определяющее значение имеет ранняя диагностика многоплодной беременности. При этом большими преимуществами, по сравнению с другими методами, обладает ультразвуковая диагностическая скрининг-программа. При отсутствии возможности широкого использования эхографии целесообразно осуществлять селективный подход к диагностике с учетом количественной оценки информативности прогностических факторов возникновения и наличия многоплодия (паратипические признаки, ВСДМ, гормональные маркеры).
У женщин с многоплодием имеется различная степень риска перинатальной заболеваемости и смертности. По наиболее характерным признакам женщины с многоплодной беременностью могут быть отнесены к группам:
I степени риска - практически здоровые женщины с отсутствием осложнений беременности, с дихориальным типом плацентации и физиологическим типом развития плодов;
II степени риска - женщины с монохориальным типом плацентации, гипотрофией плодов в сочетании с осложнениями беременности (угроза невынашивания, гестозы, анемия и др.);
III степени риска - женщины с диссоциированным развитием плодов, наличием врожденных пороков развития одного или обоих плодов, внутриутробной гибелью одного плода, гемотрансфузионным синдромом, моноамниотической двойней, осложнением беременности (угроза невынашивания, гестозы, анемия и др.).
Наличие у женщин с многоплодием двух и более факторов риска II - III степени существенно ухудшает исход беременности и родов. Так, при III степени риска, по сравнению с I, частота перинатальной смертности увеличивается в 5 раз. При высокой вероятности перинатальной смертности (III степень риска) необходимо решать вопрос о целесообразности пролонгирования беременности и медицинских показаниях к ее прерыванию на ранних сроках.
Проведенные исследования позволили обосновать и оценить клиническую эффективность основных компонентов врачебной тактики при оптимальном ведении беременности и родов у женщин с многоплодием (схема 3). Реализация предложенной программы лечебно-профилактических мероприятий позволит снизить перинатальную, материнскую заболеваемость и смертность.
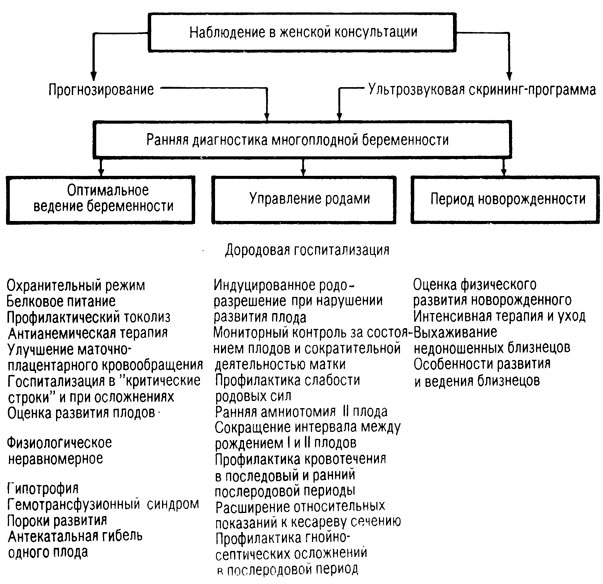
Схема 3
|
ПОИСК:
|
© ROGHDENIEREBENKA.RU, 2010-2019
При копировании материалов активная ссылка обязательна:
http://roghdenierebenka.ru/ 'Беременность, рождение и первые годы жизни ребёнка'
При копировании материалов активная ссылка обязательна:
http://roghdenierebenka.ru/ 'Беременность, рождение и первые годы жизни ребёнка'