
Изменения в организме матери и плода, обусловленные ожирением
Беременность приводит к многочисленным и сложным изменениям в организме женщины, напряжению функционального состояния различных органов и систем, их резервных и адаптационных возможностей.
Ожирение, являющееся одним из наиболее распространенных видов соматической патологии, часто оказывается неадекватной нагрузкой на организм беременной, выходящей за пределы физиологических возможностей. Поэтому изучение особенностей обмена веществ в организме рожениц с ожирением имеет важное значение для раскрытия патогенеза возникающих расстройств.
Изменение содержания общего белка, белковых фракций, иммуноглобулинов. Осложненное течение беременности и родов во многом связано с нарушениями обменных процессов в организме женщин с ожирением и, в особенности, с изменением белкового обмена в системе мать - плод.
Известно, что белки являются главной составной частью цитоплазмы клеток и выполняют важнейшие функции организма; структурную, ферментативную, защитную, двигательную. Однако состояние белкового обмена у больных ожирением изучено недостаточно.
Некоторые авторы отрицают наличие значительных изменений в состоянии белкового обмена у больных ожирением (М. Н. Егоров, Л. М. Левитский, 1964). Другие признают наличие таких изменений только при тяжелых степенях ожирения. Так, Д. Я. Шурыгин и соавторы (1975) отметили, что у больных ожирением IV степени снижено содержание общего белка, альбуминов крови и повышено количество β- и γ-глобулинов (по сравнению с больными ожирением I степени).
Н. Б. Щупак и соавторы (1973) обнаружили выраженную диспротеинемию у больных ожирением за счет снижения уровня альбуминов и увеличения грубодисперсных фракций сыворотки крови. Данные исследований Н. Б. Ковалевой (1970) и соавторов (1975) свидетельствуют об увеличении общего белка в сыворотке крови больных ожирением за счет грубодисперсных фракций, возрастании уровня всех фракций глобулинов, особенно β- и γ-, и снижении альбумино-глобулинового коэффициента.
При беременности значение белкового обмена возрастает, поскольку белки являются основным пластическим материалом для создания фето-плацентарного комплекса.
Данные относительно белкового обмена у беременных женщин и новорожденных весьма разноречивы. По мнению Т. К. Тилининой (1962), Е. Н. Круглова (1966), нормально протекающая беременность сопровождается снижением содержания общего белка сыворотки крови.
Н. А. Брянцева (1969), Л. В. Диденко (1969), Н. А. Фарбер (1970), Г. П. Кузьмина (1971), И. З. Закиров (1973), В. Н. Прохоров (1979), Г. А. Паллади и соавторы (1980) считают, что уровень общего белка крови снижается, но не выходит за пределы нижней границы нормы.
Отсутствие изменений в содержании общего белка сыворотки крови при нормально протекающей беременности отмечают М. Н. Волох-Исаева (1961), Е. А. Абурел и соавторы (1962), К. Х. Хакимова (1964), Л. Г. Сотникова (1968), В. И. Белоусова (1970), У. Ф. Амирова (1971), В. И. Ямпольская (1972), Ю. В. Тарадайко (1974).
Ряд исследователей обнаружили повышенное содержание общего белка в сыворотке крови при нормально протекающей беременности (Е. А. Могнян, 1957; Л. Л. Колпакова, 1965; Boselli и соавт., 1955; Michel, 1962).
Большинство авторов считает, что во время нормально протекающей беременности происходит снижение альбуминов, повышение глобулинов и, следовательно, уменьшение альбумино-глобулинового коэффициента (С. М. Геворкян, 1962; Е. Л. Рыбалко, 1963; Л. В. Бекер; И. А. Мануйлова и соавт., 1974; А. А. Закревский и соавт., 1977; Wilken и соавт., 1968).
Существуют и другие мнения. Так Л. Г. Сотникова (1959), В. И. Белоусова (1970), У. Ф. Амирова (1971), В. И. Ямпольская (1972) считают, что уровень у-глобулинов при нормально протекающей беременности не изменяется. Е. Н. Круглов (1966), Г. П. Кузьмина (1971), Ю. В. Тарадайко (1974) утверждают обратное.
Отсутствует также единство взглядов на характер изменений белкового обмена плода при нормально протекающей беременности (В. И. Лаврова, 1956; Г. П. Кузьмина, 1971; В. И. Лейтан, 1971; Ю. В. Тарадайко, 1974; Г. А. Паллади и соавт., 1980).
Нами изучено состояние белкового обмена в системе мать - плод у 81 роженицы с ожирением и 25 рожениц с нормальной массой тела (контрольная группа).
Данные исследований свидетельствуют, что у рожениц контрольной группы содержание общего белка сыворотки крови соответствует физиологической норме. У рожениц с ожирением уровень общего белка сыворотки крови снижается по мере прогрессирования ожирения (P<0,001). Причем если при ожирении I степени его количество - (70,0±0,08) г/л - не выходит за пределы нижней границы нормы, то при ожирении III степени отмечается гипопротеинемия - (65,0±0,09) г/л.
Уровень альбуминов крови у рожениц контрольной группы значительно снижен по сравнению с таковым у женщин вне беременности и составляет (51,3±0,64) г/л (P<0,001). Большинство авторов (К. Х. Хакимова, 1964; В. И. Белоусова, 1970; А. А. Закревский и соавт., 1977) связывают такое снижение уровня альбуминов крови у беременных с повышенным потреблением их плодом, так как альбумины содержат большое количество аминокислот, необходимых для роста и развития плода. Однако Ю. В. Тарадайко (1974) считает, что гипоальбуминемия развивается вследствие увеличения объема циркулирующей плазмы в сосудистом русле рожениц.
У рожениц с ожирением уровень альбумина сыворотки крови снижается еще больше, причем это снижение происходит пропорционально нарастанию степени ожирения (табл. 6).
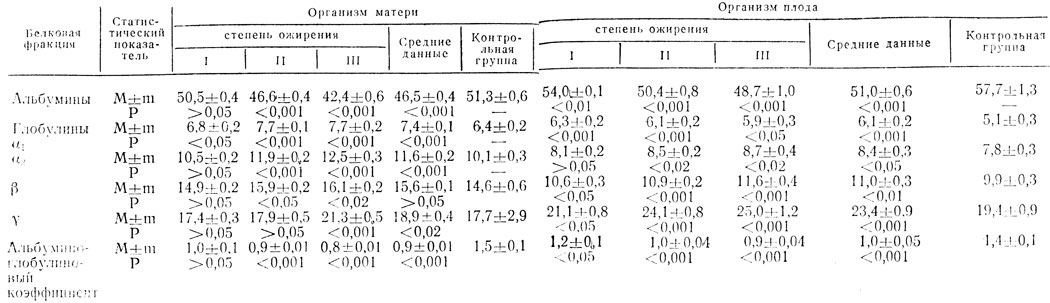
Таблица 6. Содержание белковых фракций (%) в организме матери и новорожденного
Примечание. P дано по отношению к контрольной группе.
Снижение уровня альбуминов можно связать с отягощающим влиянием ожирения на течение беременности и родов, поскольку ряд авторов (Н. Б. Ковалева, 1970; Н. Б. Щупак и соавт., 1973; Д. Я. Шурыгин и соавт., 1975), изучавших состояние обменных процессов у больных ожирением, отметили у них снижение уровня альбумина и возрастание глобулиновых фракций. Кроме того, многие авторы (Я. М. Ландау и соавт., 1969; Э. Г. Ларский, 1974, и др.) связывают гипоальбуминемию и снижение уровня общего белка крови с гормональной перестройкой организма, в частности с состоянием гипоэстрогении. Зная, что для рожениц с ожирением характерно преобладание гестагенов, можно предположить, что гормональный фон тучных женщин способствует развитию диспротеинемии. Данные Ю. В. Тарадайко (1974) об "относительной" гипоальбуминемии вследствие гидремии не находят подтверждения при обследовании женщин с ожирением, поскольку у них достоверная гипоальбуминемия сочетается с явной гиповолемией вследствие уменьшения объема циркулирующей плазмы и эритроцитов.
Гииопротеинемия и гипоальбуминемия способствуют возникновению у беременных с ожирением отеков (Л. В. Квиткова и соавт., 1983), что подтверждается и нашими данными.
По мере прогрессирования ожирения дефицит общего белка крови и альбумина нарастает и соответственно увеличивается частота поздних токсикозов беременных.
Количество глобулинов в сыворотке крови рожениц с нормальной массой тела увеличивается по сравнению с таковым у женщин вне беременности. Увеличение идет за счет всех глобулиновых фракций.
Альбумино-глобулиновый коэффициент при этом снижается до 1,1±0,05 против 1,2±2,0 у женщин вне беременности (P<0,01).
В группе рожениц с ожирением диспротеинемия еще более выражена и возрастает по мере прогрессирования ожирения (см. табл. 8). Так, с увеличением степени ожирения достоверно увеличивается (P<0,001) уровень α1 и α2-глобулинов. Количество β-глобулинов достоверно увеличивается (P<0,02) лишь при III степени ожирения, хотя тенденция к их увеличению имеется и при I - II степени. Содержание γ-глобулинов при I и II степенях ожирения существенно не изменяется, а при III степени достоверно (P<0,001) возрастает. Такое изменение β- и γ-глобулинов при III степени ожирения, по-видимому, является следствием дополнительной антигенной стимуляции, которой подвергается организм женщин с ожирением, поскольку у них в 2 - 2,5 раза чаще отмечаются инфекционные заболевания. Кроме того, этому изменению способствует высокий уровень марганца (С. М. Прегер, 1979).
Белковый состав крови новорожденных отличается от такового у родильниц. Так, уровень общего белка у новорожденных ниже, чем у родильниц, уровень альбуминов повышается, а глобулинов - снижается, альбумино-глобулиновый коэффициент возрастает.
Данные изучения фракционного состава глобулинов у новорожденных от родильниц контрольной группы свидетельствуют, что снижение их уровня происходит за счет α1 α2 и β-глобулинов. Уровень у-глобулинов увеличивается, по-видимому, за счет трансплацентарного перехода антител от матери к плоду, что обеспечивает невосприимчивость последнего к инфекционным заболеваниям. Снижение количества α1, α2 и β-глобулинов (высокоспецифичных переносчиков ряда метаболитов) свидетельствует о более низком уровне обменных процессов, происходящих в организме новорожденных.
В состоянии белкового обмена у новорожденных от женщин с ожирением отмечаются существенные изменения. В частности, значительно снижается уровень общего белка сыворотки крови, причем снижение это происходит параллельно нарастанию тяжести ожирения у матери.
Наряду с гипопротеинемией у новорожденных от женщин с ожирением отмечается гипоальбуминемия, нарастающая по мере прогрессирования ожирения. Известно, что альбумины являются основными транспортерами микроэлементов, поэтому можно предположить, что состояние гипоальбуминемии способствует возникновению нарушений в обмене микроэлементов.
В свою очередь, дисбаланс микроэлементов влияет на синтез и обмен белка.
Наряду со снижением уровня альбуминов происходит нарастание уровня глобулинов и уменьшение альбумино-глобулинового коэффициента. Увеличение уровня глобулинов происходит за счет достоверного роста α2-, β- и γ-глобулинов.
Уровень α1-глобулинов при этом уменьшается (П. О. Вязицкий и соавт., 1979).
Сравнительное изучение состояния белкового обмена в системе мать - плод у рожениц с ожирением показало, что ожирение неблагоприятно отражается на состоянии белкового синтеза как матери, так и плода, и приводит к достоверному изменению количественного и качественного состава крови.
Качественные изменения белкового состава крови влияют на повышение СОЭ, а количество глобулиновых фракций тесно коррелирует с иммуноглобулинами A, M и G (П. О. Вязицкий и соавт., 1974).
Иммуноглобулины представляют собой антитела, относящиеся к различным группам сывороточных белков. Впервые термин "иммуноглобулины" был введен в 1959 г. Heremans. В настоящее время известны иммуноглобулины A, M. G, D, E. Наиболее изучены иммуноглобулины A, M, G. Около 80% иммуноглобулинов, находящихся в сыворотке крови, составляют иммуноглобулины G, к которым относится большинство антител (Porter, 1962).
Иммуноглобулины M составляют 5 - 10% от общего количества сывороточных иммуноглобулинов. К этому виду иммуноглобулинов относятся такие антитела, как холодовые агглютинины, ревматоидный фактор, тифозные анти-о-агглютинины, антистрептококковые, антипенициллиновые, противовирусные и другие антитела (Н. В. Дуб, 1978; М. Т. Пулатова и соавт., 1979).
Иммуноглобулины А составляют около 20% от общего количества иммуноглобулинов и содержат кожно-сенсибилизирующие, противовирусные антитела, а также антитела против грамотрицательных бактерий. Кроме сывороточных существуют секреторные иммуноглобулины А, которые содержатся в слезной жидкости, слюне, желчи, молозиве, бронхиальных выделениях, кишечном соке в количестве около 30 мг на 100 мл секрета (Д. Ф. Стефани, Ю. Е. Ведьтищев, 1977).
Иммуноглобулины D составляют 0,2 - 1% всех сывороточных иммуноглобулинов. Роль их в организме почти не изучена (Rowe и соавт., 1968).
Иммуноглобулины E составляют 0,003% от общего количества иммуноглобулинов в сыворотке крови и играют ведущую роль в развитии аллергических реакций немедленного типа (Rowe, 1969).
Таким образом, иммуноглобулины являются гуморальным звеном неинфекционного иммуногенеза, они играют значительную роль в иммунологической реактивности организма на различных этапах его развития, а также при различных патологических состояниях.
Одним из важнейших аспектов иммунологических взаимоотношений между матерью и плодом является вопрос о влиянии материнского иммунитета на формирование защитных сил плода и новорожденного.
Во время беременности в организме женщины происходит перестройка гормональных, обменных и других процессов. Иммунологическая система матери также претерпевает изменения, необходимые для обеспечения защиты новорожденного от инфекции (М. Т. Пулатова и соавт., 1971; Л. П. Гридчик и соавт., 1975).
Особый интерес в изучении материнско-плодовых иммунологических сдвигов при нормально протекающей и осложненной беременности представляет изучение состояния системы иммуноглобулинов беременной женщины, так как именно иммуноглобулины матери обеспечивают специфическую защиту плода и новорожденного от инфекции на протяжении всей беременности и в период адаптации к внеутробной жизни (Г. П. Ильина и соавт., 1973; Е. Н. Андреева, 1976; Г. М. Савельева и соавт., 1979).
Данные разных авторов, касающиеся содержания иммуноглобулинов в сыворотке крови беременных и новорожденных, весьма разноречивы. Р. М. Зорина и соавторы (1983) наблюдали снижение уровня иммуноглобулинов G по мере увеличения срока беременности.
Л. Т. Кожухарова (1975), Ю. П. Резников (1975, 1976), Н. В. Дуб (1978), М. Т. Пулатова и соавторы (1979), Г. М. Савельева и соавторы (1979); Winterhoff и соавторы (1970), Maroulis и соавторы (1971), Studd (1971), Knoblock (1973), Tatra и соавторы (1974) считают, что иммуноглобулины G достигают своего максимального уровня к 36 - 38-й неделе беременности, а к моменту родов их количество уменьшается. Поскольку иммуноглобулины G являются иммунодепрессантами по отношению к антигенам плодного яйца, уменьшение их уровня перед родами расценивается как один из факторов, оказывающих влияние на отторжение плода и развитие родовой деятельности. Кроме того, плацентарный барьер преодолевают только иммуноглобулины G и они же содержат основную массу антител. Поэтому снижение содержания этих веществ в организме беременной перед родами можно объяснить активным переходом их к плоду через плаценту.
Другие исследователи (К. Н. Прозоровская и соавт., 1975; Е. А. Андреева и соавт., 1977; А. Д. Макаричева, 1979; Hobbs и соавт., 1967; Klapper и соавт., 1971; Cunev и соавт., 1973) отмечают, что количество иммуноглобулинов G к моменту родов увеличивается.
Данные исследований Guisdon (1969), Behm и соавторов (1971) свидетельствуют, что уровень иммуноглобулинов A, M, G во время беременности не изменяется по сравнению с уровнем их у женщин вне беременности.
Нет полной ясности также в том, как распределяются иммуноглобулины G в организме матери и плода. Н. Е. Есипенко и соавторы (1973), Л. С. Лозовская (1973), С. П. Маракина и соавторы (1978), West и соавторы (1962), Berg и соавторы (1969), Millar и соавторы (1972), Lemis и соавторы (1973) считают, что количество иммуноглобулинов G в пуповинной крови больше, чем в крови матери. В работах В. И. Ермолова (1971), А. А. Сохина (1981), Compogrand и соавторов (1970), Mendenhall (1970) имеются указания об одинаковом уровне иммуноглобулина G в крови матери и новорожденного. Т. С. Быстрицкая и соавторы (1980) считают, что повышение уровня иммуноглобулинов в пуповинной крови происходит вследствие морфологических изменений в плаценте, через которую проникают материнские антитела, стимулирующие образование иммуноглобулинов.
Данные относительно других иммуноглобулинов также противоречивы. Л. Т. Кожухарова (1975), Nyclicek и соавторы (1972) считают, что при нормально протекающей беременности уровень иммуноглобулинов A и M в организме женщин к моменту родов повышается, а К. Н. Прозоровская (1977), Г. М. Савельева и соавторы (1979), Donat (1975) не находят изменений уровней иммуноглобулинов А и М во время беременности.
Данные исследований Е. В. Пикулиной (1972), М. Т. Пулатовой и соавторов (1979), Tympner (1971) свидетельствуют, что в норме через плацентарный барьер проникают только иммуноглобулины G, остальные (A, M, D, E) в пуповинной крови не обнаруживаются.
Противоположного мнения придерживаются Д. В. Стефани и соавторы (1977), И. А. Земляная и соавторы (1979), Dent и соавторы (1972). Они считают, что в норме в пуповинной крови иммуноглобулины A и M могут присутствовать, но в незначительных количествах. В. И. Говалло (1975), З. М. Михайлова и соавторы (1977), К. Н. Прозоровская (1977), Г. М. Савельева и соавторы (1979) отмечают появление иммуноглобулина М в пуповинной крови детей, родившихся от матерей, иммунизированных во время беременности или перенесших инфекционные заболевания.
Таким образом, в литературе имеются весьма разноречивые данные о содержании иммуноглобулинов в крови здоровых рожениц, данные о содержании иммуноглобулинов в крови рожениц с ожирением и их плодов отсутствуют.
Синхронное изучение содержания иммуноглобулинов A, M, G в сыворотке крови, произведенное нами у 20 рожениц с нормальной массой тела (контрольная группа), у 20 с ожирением I степени, у 15 - II степени, у 10 - III степени и у их новорожденных дало результаты, позволяющие отметить, что у новорожденных от матерей контрольной группы иммуноглобулины A и M в сыворотке крови не обнаружены. Это совпадает с данными Е. В. Пикулиной (1972), М. Т. Пулатовой и соавторов (1979), Tympner (1971) и др. Иммуноглобулины G обнаруживаются в количествах, несколько превышающих их уровень у матери, однако эти данные статистически недостоверны (P>0,05). К такому же выводу пришли В. И. Ермолов (1971), Campogrande и соавторы (1970), Mendenhall (1970) и др. Полученные данные позволяют считать, что у новорожденных от матерей с нормальной массой тела нет дефицита иммуноглобулинов, то есть имеется достаточная иммунологическая активность.
У рожениц с ожирением уровень иммуноглобулинов изменяется по сравнению с их уровнем у рожениц контрольной группы. Так, средний уровень иммуноглобулинов A и M в сыворотке крови рожениц с ожирением ниже, чем у женщин с нормальной массой тела (рис. 4).
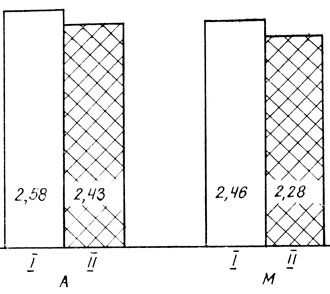
Рис. 4. Содержание иммуноглобулинов (мг/мл) A и M в контрольной (I) и основной (II) группах
При сравнительном изучении уровня иммуноглобулинов у рожениц с различной степенью ожирения оказалось, что по мере прогрессирования ожирения отмечается тенденция к уменьшению иммуноглобулинов A и M. Максимальное снижение количества имуноглобулинов М наблюдается при ожирении III степени (P<0,001).
По мнению Д. В. Стефани и соавторов (1977), Н. В. Дуб (1978), большинство противовирусных антител относится к иммуноглобулинам A и M. Поскольку беременные с ожирением болеют гриппом и острыми респираторными заболеваниями в 1,3 раза чаще, а при III степени ожирения - в 2,9 раза чаще, чем беременные с нормальной массой тела, причину этого можно усматривать в снижении иммунологической реактивности организма.
Уровень иммуноглобулинов G у беременных с ожирением достоверно повышается (P<0,001) и составляет в среднем (12,06±0,26) мг/мл. Это повышение может являться ответной реакцией организма беременной на перенесенные заболевания, так как иммуноглобулины G в значительном количестве синтезируются в ответ на вторичный антигенный стимул (А. Е. Вершигора, 1980).
Поскольку иммуноглобулины G являются иммунодепрессантами по отношению к антигенам плодного яйца, то выявленное повышение их концентрации перед родами возможно определенным образом способствует запаздыванию родовой деятельности и развитию ее слабости при ожирении рожениц.
При исследовании концентрации иммуноглобулинов G у беременных с различной степенью ожирения оказалось, что высокий уровень иммуноглобулинов имеет место только у рожениц с I и II степенями ожирения и снижается при III степени. Исходя из данных О. П. Резникова (1975), Н. В. Дуб (1978) о снижении уровня иммуноглобулинов G при тяжелом токсикозе 2-й половины беременности, можно предположить, что его снижение при ожирении III степени является следствием резкого возрастания частоты и тяжести токсикоза у этих рожениц. В целом можно отметить, что при ожирении I и II степеней отмечается повышение интенсивности иммунных реакций, граничащее с патологией, а ожирение III степени сопровождается нарушениями иммунологического ответа организма.
Учитывая, что связь между иммунологическими системами матери и плода при ожирении рожениц практически не изучена, а иммунный конфликт наряду с другими этиологическими факторами может способствовать развитию различной акушерской и перинатальной патологии, произведены исследования иммуноглобулинов A, M, G у новорожденных от матерей с различной степенью ожирения (табл. 7).

Таблица 7. Концентрация иммуноглобулинов (мг/мл) в сыворотке крови матери (X) и плода (Y)
Количественный состав иммуноглобулинов у новорожденных от матерей с ожирением претерпевает изменения. Иммуноглобулины A в сыворотке пуповинной крови отсутствовали. Концентрация иммуноглобулинов M составляла в среднем (0,24±0,046) мг/мл (P<0,001), что значительно превосходит норму.
Иммуноглобулины M в сыворотке крови новорожденных от матерей с нормальной массой тела не обнаруживались. По данным Д. В. Стефани, Ю. Е. Вельтищева (1977), максимальная нормальная концентрация этих иммуноглобулинов в пуповинной крови составляет 0 - 0,15 мг/мл. Отмечается тенденция к нарастанию концентрации иммуноглобулинов M соответственно степени ожирения.
Учитывая мнение К. Н. Прозоровской (1977), З. М. Михайловой и соавторов (1979), М. В. Комовой и соавторов (1980) о том, что высокий уровень иммуноглобулинов A и M свидетельствует о внутриутробной антигенной стимуляции, можно утверждать, что у беременных с ожирением плод подвергается дополнительному антигенному воздействию.
У новорожденных иммунологическая реактивность во многом определяется состоянием защитных сил материнского организма. Известно, что иммуноглобулины G являются единственными, которые преодолевают плацентарный барьер; они содержат основную массу антител. Следовательно, исследование содержания иммуноглобулинов G у новорожденных от матерей с ожирением представляет особый интерес, поскольку перинатальная смертность в этой группе новорожденных составляет 4,1%, а дизадаптационный синдром встречается в 10,1 раз чаще, чем в контрольной группе детей. Иммуноглобулины G обнаруживаются в пуповинной крови новорожденных от матерей с ожирением в концентрации, превосходящей норму. Однако высокий уровень иммуноглобулинов G отмечается только в крови новорожденных от матерей с I степенью ожирения, а при II и III степенях их уровень достоверно (P<0,01) снижается в соответствии со снижением последнего в крови матерей.
Многие исследователи (Ю. П. Резников, М. Н. Ярцев, 1976; Т. И. Гоцуляк, 1979; С. П. Маракина и соавт., 1978; Duvina, 1973) считают, что низкий уровень иммуноглобулинов G у новорожденных способствует возникновению инфекционных заболеваний, а повышение концентрации иммуноглобулинов M в пуповинной крови является сигналом, нередко единственным, произошедшего инфицирования плода и новорожденного. Так, Dent и соавторы (1972) отмечают что концентрация иммуноглобулинов M в пуповинной крови, в 3 раза превышающая нормальную, является признаком неонатального сепсиса. Назначение препаратов гамма-глобулина новорожденным с высоким уровнем иммуноглобулинов M и низким уровнем иммуноглобулинов G усиливает защитную реакцию организма, что приводит к уменьшению смертности в этой группе детей.
Результаты наших исследований позволяют отметить повышение концентрации иммуноглобулинов M и снижение концентрации иммуноглобулинов G но мере нарастания ожирения рожениц. Согласно данным М. Н. Ярцева (1979), С. Е. Беляева и соавторов (1980), антигенное воздействие во время беременности ускоряет процесс созревания иммунной системы и вызывает более ранний синтез антител, что наблюдается у новорожденных от матерей с ожирением. Раннее возбуждение аппарата иммуногенеза может сопровождаться быстрым истощением функции иммунной системы, что сказывается на показателях заболеваемости и смертности этой группы новорожденных. Эти данные свидетельствуют о необходимости коррекции выявленных нарушений путем включения в лечебный комплекс препаратов типа гамма-глобулина, пентоксила и др.
Таким образом, при ожирении отмечаются существенные сдвиги в организме беременных, которые оказывают влияние не только на обменные процессы, но и на состояние иммунологической реактивности в системе мать - плод.
Изменения липидного обмена. Липидами называют нейтральные жиры и жироподобные соединения (липоиды), которые входят в состав тканей растений, животных и человека.
Липиды являются природными концентратами большой энергетической ценности, структурными компонентами клетки и субклеточных образований. Эти вещества обеспечивают мембранную проницаемость клеток, служат исходными продуктами для синтеза биологически активных соединений (ферментов, гормонов, витаминов, простагландинов) и тем самым влияют на функции центральной нервной системы, эндокринных желез, устойчивость организма к определенным заболеваниям и поддержание гомеостаза.
Для выполнения важнейших функций транспорта и накопления липиды образуют комплексы с белками (липопротеиды) и в таком виде входят в состав всех живых организмов.
В литературе до сих пор нет единого мнения относительно показателей жирового обмена у людей с ожирением. Так, С. Ф. Губанова и соавторы (1975), Е. А. Беюл и соавторы (1977), Е. А. Васюкова и соавторы (1977), Rifkind и соавторы (1968) полагают, что у больных ожирением отмечается глубокое нарушение жирового обмена, выраженное в повышении концентрации в крови общих липидов, неэстерифицированных жирных кислот, холестерина, триглицеридов, фосфолипидов, β-липопротеидов и сопровождающееся снижением лецитин-холестеринового коэффициента. То есть при ожирении происходят нарушения в биосинтезе и расходовании жира, причем процессы липогенеза вследствие хронической перегрузки энергетическим материалом превалируют над липолизом.
По данным В. А. Оленевой (1970), при I степени ожирения содержание неэстерифицированных жирных кислот увеличивается по сравнению с нормой в 2,2 раза, р-липопротеидов - в 1,5, триглицеридов - в 1,8 раза. При ожирении II степени p-липопротеиды увеличиваются в 1,7 раза, а при III - IV степени - в 1,6. Триглицериды увеличиваются соответственно в 2,4 и в 2 раза. Д. Я. Шурыгин и соавторы (1975) обнаружили нарастание уровня холестерина при I, II и III степени ожирения и резкое снижение этого показателя при IV степени ожирения.
По данным В. Д. Рыжикова (1979), зависимости между показателями холестерина и степенью ожирения нет, однако имеется коррелятивная зависимость между уровнем р-липопротеидов и массой тела больных: содержание β-липопротеидов увеличивается при I - III степени ожирения; при IV степени ожирения происходит резкое снижение этого показателя.
В. А. Оленева (1970), М. Н. Мокина (1972) и др. отмечают своеобразную метаболическую инертность жировой ткани при ожирении. Так, активность липазы и липопротеидлипазы у лиц с ожирением соответственно в 5 и 2,6 раза ниже нормы.
Некоторые исследователи (В. С. Татевосян, 1967; Н. Б. Шупак и соавт., 1973) вообще не обнаружили изменений в показателях жирового обмена у лиц с ожирением.
Показатели жирового обмена дают возможность судить об энергетических процессах, происходящих в миометрии (Florian и соавт., 1970). Уровень жирных кислот влияет на биосинтез простагландинов (А. Н. Климов и соавт., 1978). Следовательно, липиды имеют несомненное значение для своевременного развития и нормального течения родового акта.
Кроме того, липиды поставляют энергию для плода и новорожденного, служат пластическим материалом для построения структурных компонентов клеток, определяют зрелость легочной ткани, являются предшественниками стероидных гормонов, влияют на массу тела новорожденного (Л. Н. Мачулина, 1974; Ю. В. Тарадайко, 1974; М. Г. Касабян, 1979; Е. Т. Михайленко и соавт., 1980; Novak, 1961). Определение соотношения фракций фосфолипидов (лецитин/сфингомиелин) позволяет диагностировать степень зрелости легких новорожденных и прогнозировать их состояние (П. И. Цапок, 1978; К. А. Курышева и соавт., 1983).
Данные исследований Ю. Г. Браткова (1976), Г. Н. Куярова и соавторов (1979) свидетельствуют, что уровень общего, свободного холестерина и эфиров холестерина в крови матери при нормально протекающей беременности снижается. А. И. Якубова (1968), В. И. Ямпольская (1972), С. В. Уголева (1977), Green (1966) утверждают обратное.
Еще более противоречивы данные о содержании липопротеидов в сыворотке крови здоровых беременных женщин. Так, Ю. В. Тарадайко и соавторы (1974) отмечают при нормально протекающей беременности увеличение α- и β-липопротеидов, Н. А. Брянцева (1970), Е. Ф. Губанова и соавторы (1975) - снижение а-липопротеидов и повышение β-липопротеидов, В. И. Белоусова (1970) - уменьшение β-липопротеидов и повышение α-липопротеидов.
По нашим данным, у родильниц с нормальной массой тела концентрация общего холестерина, фосфолипидов, общих липидов в сыворотке крови повышена, однако не выходит за пределы биологической нормы (табл. 8).
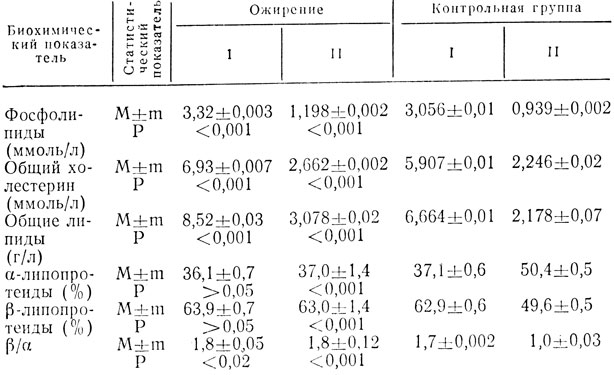
Таблица 8. Содержание липидов, липопротеидов и холестерина в сыворотке крови матерей (I) и новорожденных (II)
Учитывая, что липиды служат исходными продуктами для синтеза стероидных гормонов, а фосфолипиды и холестерин являются основными составными элементами клеточных мембран, можно предположить, что повышение активности метаболизма липидов при беременности является физиологической реакцией, направленной на обеспечение оптимальных условий развития плода.
Количественный состав липопротеидов при беременности также претерпевает изменения.
Уровень α-липопротеидов в сыворотке крови повышается, β-липопротеидов снижается, а коэффициент β/α уменьшается (см. табл. 8).
Поскольку для α-липопротеидов характерно содержание большого количества белка, а для β-липопротеидов - липидов, можно считать, что дизлипопротеинемия свидетельствует о большей интенсивности процессов белкового обмена во время беременности.
У новорожденных от матерей с нормальной массой тела концентрация фосфолипидов, общего холестерина и общих липидов в сыворотке крови в 2,6 - 3,3 раза меньше, чем у матерей, что соответствует данным В. И. Ямпольской (1972). Такое резкое снижение уровня липидов свидетельствует о высокой степени их утилизации органами и тканями плода. Кроме того, по мнению Е. Т. Михайленко, М. Я. Чернеги (1980), гипохолестеринемия плода может быть связана с трудностью проникновения холестерина через плацентарный барьер.
Для новорожденных этой группы характерен также высокий уровень α-липопротеидов и низкий уровень β-липопротеидов. Отношение β-липопротеидов к α-липопротеидам уменьшается.
У беременных с ожирением концентрация общих липидов в крови значительно возрастает. Уровни общего холестерина и фосфолипидов превышают аналогичные показатели у беременных контрольной группы (P<0,001). Отмечается снижение концентрации а-липопротеидов и увеличение 13- липопротеидов (А. Г. Пап и соавт., 1978; К. Б. Акунц и соавт., 1983).
Гиперхолестеринемия и увеличение (3-липопротеидов способствуют развитию позднего токсикоза беременности, внутриутробной гипоксии и гибели плода (Е. Т. Михайленко и соавт., 1980; Л. В. Квиткова и соавт., 1983), а увеличение концентрации общих липидов, эфиров холестерина, β- липопротеидов способствует образованию избыточной массы тела у новорожденных (В. И. Ямпольская, 1972; М. Г. Касабян, 1979; К. А. Курышева и соавт., 1983).
Кроме того, количество холестерина находится в связи с концентрацией РНК в тканях, при увеличении количества холестерина концентрация РНК снижается (В. Н. Прохоров, 1979). Низкий уровень РНК является одним из патогенетических моментов, обусловливающих слабость родовой Деятельности (Л. В. Тимошенко и соавт., 1981; Е. П. Чернуха, 1982).
Сдвиги в состоянии жирового обмена могут быть связаны с нарушением функции печени, нарастающим по мере прогрессирования ожирения. В. Н. Прохоров (1979), К. Б. Акунц и соавторы (1982) считают, что увеличение концентрации β-липопротеидов и холестерина является диагностическим тестом, свидетельствующим о поражении печени.
В организме новорожденных от матерей с ожирением тоже отмечаются извращения в метаболизме липидов. Концентрация фосфолипидов, холестерина, общих липидов в сыворотке крови новорожденных от женщин с ожирением значительно превышает концентрацию их в сыворотке крови у детей контрольной группы новорожденных, что согласуется с данными М. Г. Касабяна (1979). Достоверно снижается уровень а-липопротеидов, возрастает уровень β-липопротеидов и увеличивается коэффициент β/α. Интересно отметить, что если у новорожденных контрольной группы количество а-липопротеидов значительно превышает их содержание в крови матерей, то в основной группе эти показатели находятся почти на одном уровне.
По мнению М. Г. Касабян (1979), нарушения липидного обмена у новорожденных от матерей с ожирением являются результатом антенатальной гипоксии, вызванной состоянием последних.
При изучении липопротеидов у новорожденных от матерей с ожирением оказалось, что максимальное снижение а-липопротеидов отмечается при I степени ожирения. При II и III степенях количество а-липопротеидов достоверно возрастает (табл. 9), хотя в целом остается ниже, чем у новорожденных контрольной группы.

Таблица 9. Изменение концентрации липопротеидов новорожденных при различной степени ожирения матерей (%)
Учитывая, что а-липопротеиды выполняют ведущую роль в транспортировке белка, а у матерей с ожирением и их новорожденных отмечается гипопротеинемия, (общий бедок у матерей составляет 67,0 г/л, у новорожденных - 55,0 г/л), можно предположить, что дизлипопротеинемия родильниц с ожирением и их новорожденных связана с нарушение белкового обмена.
Увеличение а-липопротеидов у матерей с ожирением II - III степени и у их новорожденных носит по всей видимости, компенсаторный характер, поскольку по мере прогрессирования ожирения возрастает и гипопротеинемия.
Увеличение количества холестерина в крови матерей и новорожденных при ожирении также может быть связано с уменьшением содержания белка, так как меньшее количество белка может связать меньшее количество холестерина и его общий уровень в крови повышается. Росту уровня холестерина способствует также увеличение в крови беременных с ожирением количества марганца и цинка, которые активируют биосинтез холестерина.
Возрастание показателей жирового обмена у матери и у плода ведет к увеличению массы тела новорожденных (В. И. Ямпольская, 1972; М. Г. Касабян, 1979). Это подтверждают и данные наших исследований: средняя масса тела новорожденных при ожирении матерей больше на 376,6 г, чем у новорожденных контрольной группы, а частота рождения крупных плодов достигает 31,9% случаев.
Приведенные данные свидетельствуют, что ожирение вызывает расстройство жирового обмена в системе мать - плод, проявляющееся в метаболической дизадаптации, влияющей на функции ряда органов и систем. У новорожденных отмечаются большие отклонения от нормы, чем у матерей, что, безусловно, сказывается на дизадаптации новорожденных к внеутробной жизни и повышает риск перинатальной смертности.
Изменения углеводного обмена. Углеводы обеспечивают около 2/3 энергозатрат организма человека. Углеводы используются для синтеза биологически важных соединений - гликопротеидов, нуклеиновых кислот, коферментов (НАД, НАДО, ФАД, КоА), иммуноглобулинов, АТФ и др. Они оказывают антикетогенное действие, стимулируя окисление ацетилкоэнзима A, образующегося при окислении жирных кислот. Кроме того, углеводы играют ведущую роль в регуляции моторной функции кишок и желчевыводящих протоков.
Избыток углеводов превращается в организме в гликоген, локализующийся в основном в печени и скелетных мышцах и использующийся по мере реализации различных физиологических функций. При поступлении в организм чрезмерного количества углеводов последние превращаются в жир и откладываются в жировых депо.
Углеводы подразделяются на моносахариды (глюкоза, фруктоза, галактоза и др.), олигосахариды (сахароза, мальтоза, лактоза), полисахариды (гликоген, крахмал, целлюлоза). Важнейшим представителем углеводов является глюкоза - наиболее легко используемый источник энергии и непосредственный предшественник гликогена. Среднее содержание глюкозы в крови человека составляет 4,4 - 6,6 ммоль/л. Это постоянство поддерживается за счет образования глюкозы из гликогена и выведения излишков ее (при пищевой гипергликемии) с мочой.
По мнению большинства авторов (В. И. Бодяжина, К. Н. Жмакин, 1970, и др.), состояние углеводного обмена при беременности почти не изменяется. Концентрация глюкозы в крови обычно нормальная. В некоторых случаях, при избыточном потреблении углеводов, отмечается глюкозурия, что объясняется изменением функции надпочечников, повышением проницаемости почечного эпителия.
Ожирение, сопровождающееся изменениями белкового и жирового обмена, отражается и на состоянии углеводного обмена. Так, В. А. Оленева (1970), изучив гликемические кривые у 300 больных ожирением, выявила концентрацию глюкозы в крови в пределах нормы у 68% из них, ниже нормы - у 13% и только у 19% больных ожирением уровень глюкозы в крови натощак был выше 6,6 ммоль/л. Характерно, что при небольшой длительности заболевания чаще наблюдались низкие показатели концентрации глюкозы, а при большом сроке - высокие.
После нагрузки глюкозой концентрация ее в крови ниже нормы была отмечена в 82,3%, а гипергликемическая фаза - в (43,5±2,1)% случаев. У большинства больных была значительно выражена гипогликемическая фаза, причем падение концентрации глюкозы после нагрузки было более выраженным, чем у здоровых лиц.
Следовательно, при ожирении имеется повышенная толерантность к углеводам, что выражается в снижении гипергликемической фазы и увеличении гипогликемического коэффициента. При этом не исключается дисфункция продукции инсулина, однако, по мнению В. А. Оленовой (1970), снижение максимального уровня глюкозы у больных ожирением связано с повышением гликогенеза в печени.
Более резкое падение концентрации глюкозы в крови в конце исследования объясняется повышенным выбросом инсулина в кровь, который стимулирует поглощение глюкозы жировой тканью, а также пентозный и гликолитический циклы ее обмена, способствуя синтезу высших жирных кислот и триглицеридов из продуктов углеводного обмена.
Таким образом, при ожирении имеется гиперинсулинизм, который способствует повышению толерантности к углеводам и только при длительных сроках ожирения развивается истощение инсулярного аппарата, что проявляется сахарным диабетом.
Состояние углеводного обмена у беременных с ожирением неустойчиво. И. И. Хачатрян (1979) кроме обычных клинических исследований концентрации глюкозы в крови и моче изучил гликемические кривые при проведении теста толерантности к глюкозе (ТТГ) у 117 беременных с ожирением. Лишь у 2 из них выявлен сомнительный тип сахарной кривой, причем после родов сахарная кривая вновь нормализовалась. Показатели у остальных женщин оставались в пределах нормы, что позволило сделать заключение о непосредственном неблагоприятном влиянии ожирения (без наличия сахарного диабета) на течение беременности и состояние плода.
Изменения водного обмена. Количество воды в организме женщин составляет 65 - 70% массы тела (40 - 50 л), в том числе 45 - 50% (30 - 35 л) приходится на внутриклеточный сектор, 15% (10 - 12 л) - на интерстициальный и 5% (3,5 л) на внутрисосудистый.
Два последних сектора составляют внеклеточное водное пространство.
Известно, что наряду с пластической функцией вода является универсальным растворителем и наиболее употребляемым реактивом в цепи химических превращений на клеточном уровне.
Клеточные мембраны разделяют внеклеточную и внутриклеточную среду, участвуя в процессах перемещения воды и электролитов, поддержания постоянства внутренней среды организма.
Жидкость, поступающую в организм, подразделяют на экзогенную (1200 мл в виде напитков и 1000 мл в виде пищевых продуктов) и эндогенную, образующуюся в результате метаболического окисления (300 - 350 мл).
Выделение воды, как известно, происходит с участием почек (1400 мл), путем перспирации (1000 мл), а также с фекалиями (100 мл). Почкам принадлежит основная роль в регуляции водно-электролитного гомеостаза. Выделение воды через кожу и легкие зависит от степени гидратации и температуры тела, а также влажности окружающего воздуха.
Количество воды зависит от вида ткани. Так, в мышечной ткани она составляет 75% от общей массы, а в жировой - 30% (Л. П. Чепкий и соавт., 1983).
В организме больных ожирением имеется избыточное количество жидкости, обусловленное снижением относительной потери воды на 1 кг массы тела (В. П. Смольникова и соавт., 1970). А. Я. Губергриц, Ю. В. Линевский (1977) отмечают, что задержке воды в организме способствуют избыточное питание и преобладание в рационе углеводов и белков. По мнению большинства авторов, переедание и преимущественное потребление углеводов наблюдается у 90% лиц с ожирением.
Состояние водного обмена при беременности характеризуется склонностью к задержке воды в организме (Д. А. Вахнина и соавт., 1975), что связано, главным образом, с замедленным выведением натрия хлорида. Накопление жидкости происходит во внеклеточном пространстве, в основном в его интерстициальном секторе (Р. А. Ваниев, 1974; Т. В. Борима и соавт., 1977).
По данным Г. А. Паллади и соавторов (1980), общий объем жидкости у здоровых женщин к концу нормально протекающей беременности, равен (49,27±1,23) л, что составляет (69,59±1,05)% от всей массы тела.
У беременных с ожирением отмечаются нарушения водно-солевого обмена, повышается проницаемость капилляров, что служит благоприятным фоном для развития токсикоза.
Содержание микроэлементов в крови. В нормальной жизнедеятельности организма особая роль принадлежит микроэлементам - веществам, которые входят в организм в малых концентрациях (P<0,001). К ним относятся: медь, марганец, цинк, хром, кремний, кобальт, алюминий и др.
Согласно классификации А. А. Покровского и соавторов (1981), микроэлементы подразделяются на 3 группы. К 1-й группе относятся эссенциальные микроэлементы, необходимые для нормальной жизнедеятельности и входящие в состав пищевых продуктов (медь, цинк, марганец, кобальт, молибден, хром, никель, олово, ванадий, йод, фтор, селен, кремний). Дефицит эссенциальных микроэлементов ведет к специфическим структурным и функциональным нарушениям, которые могут быть устранены только после введения недостающего микроэлемента. Ко 2-й группе относятся токсические микроэлементы, поступление которых в организм может вести к развитию тяжелого отравления (ртуть, свинец, кадмий, мышьяк). К 3-й группе относятся нейтральные (инертные) микроэлементы, не оказывающие выраженного физиологического или токсического воздействия на организм (бор, литий, алюминий, серебро, рубидий, барий).
Данные исследований многих авторов убедительно свидетельствуют о большом значении микроэлементов для жизнедеятельности организма, нормального функционирования его органов и систем, протекания физиологических процессов (Г. А. Бабенко, Л. П. Решеткина, 1971, и др.). Микроэлементы входят в состав многих витаминов, гормонов, ферментов, пигментов и других биологически активных веществ, являясь их активаторами или ингибиторами. Следовательно, микроэлементы оказывают выраженное влияние на обмен белков, жиров, углеводов, на процессы роста, размножения, кроветворения, тканевого дыхания и другие физиологические процессы в организме. Однако, несмотря на значительные успехи, достигнутые за последние годы в изучении обмена микроэлементов, вопрос о содержании их в организме матери и плода, влиянии на нормальное течение беременности и родов, роли в патогенезе различных акушерских заболеваний изучен недостаточно. Необходимо отметить, что нарушение нормального развития плода обусловлено, как правило, не дефицитом основных питательных веществ (белков, жиров, углеводов), а недостатком аминокислот, микроэлементов, витаминов (А. П. Кирющенков, 1978).
В. А. Кононихина (1978), В. А. Мищерякова (1979), С. М. Прегер (1979) считают, что недостаток микроэлементов сопровождает целый ряд патологических состояний у матери и плода. Так, анемия беременных, гипогалактия, пороки развития, нарушения деятельности желез, не имеющих протоков, развитие токсикоза, слабости родовой деятельности, снижение иммунологической реактивности организма и многие другие патологические процессы связаны с дефицитом микроэлементов или нарушением их соотношения.
Одним из незаменимых микроэлементов, недостаток которого ведет к значительным нарушениям в обмене веществ, является медь.
Так, медь принимает участие в синтезе гемоглобина (И. Н. Усов, 1969), потенцирует действие фоллитропина и ослабляет действие лютропина (М. Т. Пулатова, 1972), входит в состав аскорбиноксидазы, тесно коррелирует с витамином А. В свободном состоянии ионы меди обладают окислительным действием, аналогичным действию оксидазы, каталазы, пероксидазы (М. Г. Коломийцева и соавт., 1971). Особенно высокая биологическая активность меди проявляйся в соединении с белками. В состав эритроцитов медь входит в виде медьсодержащего белка эритрокупреина. В плазме крови 92 - 96% меди находится в связанном состоянии с α2-глобулинами. Это белковое соединение называется церуплазмином и состоит из 8 атомов меди и 1 молекулы α2-глобулина (Г. А. Бабенко, 1965; Laurell, 1960).
М. И. Школьник (1965) и Е. Н. Анфиногенова (1970) считают, что медь играет существенную роль в белковом обмене. В эксперименте установлено изменение количества белка крови при длительном введении в организм меди. В настоящее время известно около 25 медьсодержащих белков и ферментов (А. А. Покровский и соавт., 1981).
Данные исследований А. А. Ходак (1967) и др. свидетельствуют о влиянии меди на жировой обмен, а исследований Л. Р. Ноздрюхиной и соавторов (1973) - о влиянии на углеводный обмен.
Медь в малых дозах не влияет на свертываемость крови, а в больших - повышает ее (А. И. Педченко, 1970). Медь также способствует повышению иммунобиологической устойчивости и сопротивляемости организма, участвует в тканевом дыхании.
Во время нормально протекающей беременности отмечается повышенное содержание меди в крови (Е. П. Гребенников, 1970, и др.). Вследствие ингибирующего действия на холинэстеразу (В. С. Артамонов, 1966), активизации окисления янтарной кислоты в митохондриях мышечных клеток матки (М. Н. Школьник, 1965), нормализации процессов дыхательного и гликолитического фосфорилирования (А. А. Ходак, 1967) и участие в других сложных биологических процессах в мышечной ткани матки медь играет важную роль в своевременном начале родовой деятельности и в нормализации моторной функции матки. По данным В. А. Самойленко (1970), при переношенной беременности и слабости родовой деятельности отмечается пониженное содержание меди в крови. Д. Я. Шурыгин, А. З. Сериков (1974) установили, что в крови больных ожирением уровень меди снижается, причем дефицит ее нарастает соответственно степени ожирения.
В настоящее время достаточно изучена роль меди в патогенезе различных осложнений беременности: токсикоза (Г. П. Лисица, 1977), слабости родовой деятельности (А. А. Ходак, 1967), переношенной беременности (Е. П. Гребенников, 1970), резус-несовместимой беременности (В. З. Солоухин, 1969) и экстрагенитальной патологии (А. И. Педченко, 1970).
Вопрос о количестве меди в организме беременных с ожирением почти не освещен. Нами проведено исследование количества меди (а также цинка и марганца) в организме 112 рожениц с ожирением и у 28 рожениц с нормальной массой тела (контрольная группа). Результаты исследования приведены в табл. 10.

Таблица 10. Количество меди в системе мать-плацента-плод (мг %)
У рожениц с нормальной массой тела количество меди в плазме крови в 3,7 раза превышает количество ее в форменных элементах крови.
У рожениц с ожирением количество меди в плазме крови в 1,3 раза превышает количество ее в форменных элементах крови.
Переход меди из плазмы в форменные элементы крови У женщин с ожирением можно расценивать как компенсаторный процесс, способствующий усилению окислительновосстановительных процессов в организме, поскольку при ожирении интенсивность последних снижена, а медь являйся активатором окислительных ферментов (М. Г. Коломийцева и соавт., 1970).
В среднем у рожениц с ожирением количество меди в цельной крови значительно ниже, чем в крови рожениц с нормальной массой тела - соответственно (19,7±1,6) мг% и (25,4±0,3) мг%.
Сопоставление экспериментальных данных о количестве меди в крови матери с клиническими наблюдениями, показателями белкового, жирового обменов и состоянием системы иммуноглобулинов у матери и плода позволяет предположить, что дефицит меди может неблагоприятно сказываться на состоянии обмена белков, жиров и на показателях иммунобиологической реактивности организма. Гипокупремия рожениц с ожирением возможно способствует развитию таких осложнений, как поздний токсикоз, анемия, перенашивание беременности, гипертензия, слабость родовой деятельности.
Для характеристики обмена меди между организмами матери и плода нами произведено исследование ткани плаценты, ее оболочек и пуповины у рожениц с ожирением и у рожениц с нормальной массой тела (см. табл. 10).
Учитывая влияние меди на процессы окислительного фосфорилирования (Л. Р. Ноздрюхина и соавт., 1973), обмен белков (Е. Н. Анфиногенова, 1970; Е. П. Гребенников, 1979), липидов (А. А. Ходак, 1967), гормональный профиль организма женщин (М. Т. Пулатова, 1972, и др.), антихолинэстеразное действие меди (В. С. Артамонов, 1966), можно предположить, что снижение количества меди в ткани плаценты у рожениц с ожирением, несмотря на компенсаторное его увеличение в плодовых оболочках и пуповине, сказывается на патогенезе развития таких осложнений, как перенашивание беременности, слабость родовой деятельности, нарушение белкового и липидного обмена у новорожденных.
На фоне изменений в тканях плаценты, плодовых оболочек и пуповины отмечается перераспределение содержания меди в пуповинной крови плода. Так, если в форменных элементах крови плодов рожениц с нормальной массой тела средние показатели количества меди составляют (18,8±0,2) мг%, что в 4 раза превышает содержание их в плазме, то у плодов рожениц с ожирением средние показатели меди в форменных элементах крови - (11,3±1,6) мг% - приближаются к аналогичным показателям в плазме крови - (11,4±1,4) мг%. Причем с увеличением степени ожирения количество меди в форменных элементах крови плода достоверно снижается (P<0,001), а в плазме крови увеличивается (P<0,001).
В крови плодов рожениц с ожирением отмечается гипогкупремия, хотя и менее выраженная, чем у матерей, и дизкупремия, проявляющаяся в усиленном выходе меди из форменных элементов в плазму, что, возможно, способствуем нарушению обмена белков, снижению защитных сил по развитию дизадаптационного синдрома у новорожденных.
Цинк также является жизненно важным микроэлементом, поскольку он участвует в построении и функционировании многих ферментных систем. Так, цинк входит в состав карбоксипептидазы, карбоангидразы, оказывает активирующее влияние на пероксидазу, аминопептидазу, 3энолазу, аргиназу, ингибирует действие фосфоглюкомутазы, сукциноксидазы, протеазы, щелочной фосфатазы. (А. Я. Губергриц и соавт., 1977, и др.).
Наряду с участием в функционировании ферментных сплетем цинк влияет на процессы биосинтеза белка и нуклеиновых кислот (Л. Р. Ноздрюхина, 1977; А. А. Покровский и У соавт., 1981), активирует синтез витаминов C и P. (М. Г. Коломийцева и соавт., 1970). Кроме того, он участвует в обмене углеводов и жиров. Цинк является составной частью инсулина, усиливает его гипогликемический эффект, оказывает липотропное действие. Согласно экспериментальным данным, при увеличении в рационе животных цинка (по сравнению с медью) в плазме крови возрастает уровень холестерина (Н. М. Судакова, 1970; А. Я. Губергриц, 1977; ИЛ. Р. Ноздрюхина, 1977).
Цинк потенцирует действие питуитрина, антидиуретического и тиреотропного гормонов гипофиза. Соли цинка осклабляют действие фолликулостимулирующего и усиливают У влияние лютеинизирующего гормонов (М. Г. Коломийцева и соавт., 1970; М. Т. Пулатова, 1972).
Данные исследований С. М. Прегер (1979) и др. свидетельствуют о влиянии цинка на состояние иммунологической реактивности организма.
Многие авторы отмечают существенную роль цинка в патогенезе различных заболеваний человека.
Д. Я. Шурыгин, А. З. Сериков (1974) установили, что у больных ожирением количество цинка в крови уменьшается, причем с увеличением степени ожирения происходит более резкое снижение количества цинка. Во время беременности и родов концентрация цинка в крови и мышцах матки увеличивается, что свидетельствует о значении цинка как биоакатализатора родовой деятельности (А. А. Ходак, 1967; И.В. С. Артамонов, 1970).
Учитывая влияние цинка на белковый, углеводный, жировой обмены, процессы тканевого дыхания и другие важные физиологические функции организма, изучение обмена цинка имеет немаловажное значение для выяснения патогенеза и профилактики осложнений во время беременности и родов.
Количество цинка в цельной крови рожениц с нормальной массой тела составляет (28,8±0,46) мг%. У рожениц с ожирением количество цинка в цельной крови увеличивается в 1,9 раза и составляет (53,9±3,0) мг%. Цинк является гормонозависимым микроэлементом, обычно связанным с гестагенами. Учитывая, что при ожирении в организме рожениц создаются условия для преобладания гестагенов, увеличение количества цинка можно объяснить отмеченным обстоятельством.
При изучении количества цинка в цельной крови рожениц с различными степенями ожирения выявлено достоверное увеличение (P<0,001) его в случаях ожирения I и 1 II степени. У рожениц с ожирением III степени отмечается уменьшение количества цинка (P<0,001) по отношению к роженицам с ожирением I и II степени. Однако уровень его остается почти в 2 раза выше (P<0,001), чем у рожениц контрольной группы (табл. 11).
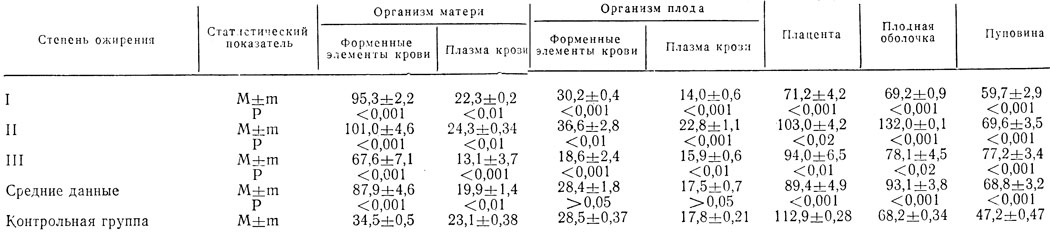
Таблица 11. Количество цинка в системе мать - плацента - плод (мг%)
Известно, что недостаток цинка приводит к задержке с роста плода (Л. Р. Ноздрюхина, 1977). Логично предположить, что высокий уровень цинка создает предпосылки для развития крупного плода.
Перераспределение цинка происходит, вероятно, за счет нарушения обмена (в том числе белкового), имеющего место при ожирении III степени. Цинк же находится в тесной связи с белками крови. Ожирение III степени характеризуется значительным уменьшением количества общего белка и изменением состояния белковых фракций крови, что влечет за собой уменьшение количества цинка в крови рожениц с III степенью ожирения, а впоследствии и у плода.
При раздельном определении количества цинка в крови я рожениц с ожирением установлено, что общее увеличение его происходит за счет накопления в форменных элементах крови, которое составляет (87,9±4,6) мг% против (19,9±1,4) мг% в плазме крови.
Особенно резкое уменьшение количества цинка в плазме крови происходит при ожирении III степени, что указывает на критическое состояние компенсаторных реакций организма при тяжелой степени ожирения.
В крови плода количество цинка также изменяется (см. табл. 11).
Выявленные нарушения обмена цинка в системе мать - плацента - плод у рожениц с ожирением весьма неблагоприятно отражаются на состоянии матери и плода, на течении родов. Следовательно, показатель количества цинка может служить косвенным тестом прогнозирования тяжести к патологии рожениц.
Марганец также относится к эссенциальным микроэлементам, необходимым для нормальной жизнедеятельности организма. Марганец содержится во всех органах и тканях организма человека и является синергистом меди, способствует усвоению последней организмом.
Марганец входит в состав некоторых ферментов (1-лейцинаминопептидазы), активирует фосфатазу крови и тканей, пептидазу сыворотки крови, декарбоксилазу пировиноградной и кетоглютаровой кислот, стимулирует окислительные процессы в организме, эй регулирует интенсивность тканевого дыхания (А. Я. Губергриц и соавт., 1977; М. Н. Рыжкова и соавт., 1980).
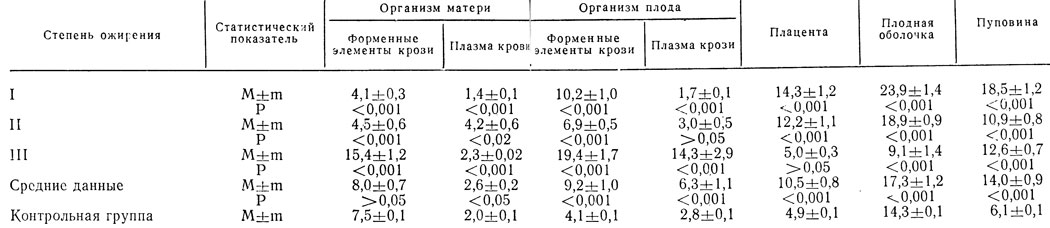
Таблица 12. Количество марганца в системе мать-плацента-плод (мг%)
Марганец необходим для эритропоеза и синтеза гемоглобина (А. И. Войнар, 1960; А. А. Озол, 1960), оказывает существенное воздействие на функцию желез, не имеющих протоков, и обмен углеводов. Экспериментальными исследованиями установлено, что марганец усиливает гипогликемический эффект инсулина, снижает уровень глюкозы в крови. Дефицит марганца приводит к уменьшению числа панкреатических островков и ухудшению усвоения глюкозы (В. И. Медведева, 1966; Л. Р. Ноздрюхина и соавт., 1973). Кроме того, марганец активизирует синтез витаминов В, С. участвуя в жировом обмене (стимулирует биосинтез холестерина и жирных кислот). Экспериментально доказано липотропное действие марганца, приводящее к ослаблению жировой инфильтрации печени и уменьшению атеросклероза сосудов (Ф. Ф. Боечко, 1974; А. А. Покровский и соавт., 1981).
Марганец является стимулятором иммуногенеза, активируя неспецифический иммунитет и ускорение образования антител (Ю. И. Бажора, 1975). Это действие марганца связано в основном с его влиянием на белковый синтез. Данные исследований С. М. Прегер (1979) свидетельствуют, что марганец стимулирует рост β-глобулиновой фракции, которая содержит антитела.
Во время беременности уровень марганца в крови возрастает (Е. П. Гребенников, 1970; В. А. Мищерякова, 1979) что рассматривается как компенсаторная реакция, направленная на активизацию окислительно-восстановительных процессов в организме (В. И. Медведева, 1966).
По данным А. И. Педченко (1970), биотические дозы марганца снижают активность холинэстеразы и таким образом способствуют нормализации моторной функции матки во время родов. Согласно сведениям Е. П. Гребенникова (1970), В. А. Самойленко (1970), К. С. Григоровой (1972) при запоздалых родах уровень марганца в организме снижается.
Марганец в биодозах оказывает благоприятное влияние на течение беременности, родов и внутриутробное развитие плода, что объясняется нормализацией обменных процессе в материнском организме. А. И. Педченко (1970), Е. П. Гребенников (1970) отмечают увеличение массы плода при обогащении пищевого рациона беременной марганцем.
У рожениц с ожирением, по нашим данным, среднее количество марганца в цельной крови соответствует его уровню у рожениц контрольной группы, соответственно (5,3±0,5) и (5,25±0,1) мг%. Однако у рожениц с ожирением I степени уровень марганца низкий - (2,8±0,02) мг%. При ожирении II степени количество марганца несколько повышается, а при III степени - резко возрастает и составляет У (8,9±0,6) мг%. Очевидно, низкий уровень марганца у рожениц с ожирением I степени отражает ослабление активности окислительных процессов в организме при ожирении. При ожирении II степени, по-видимому, включаются компенсаторные механизмы, направленные на интенсификацию У процессов тканевого дыхания, в связи с чем повышается уровень марганца в крови. У больных ожирением III степени отмечается напряжение компенсаторных механизмов, направленных на ликвидацию кислородного голодания, в связи с чем резко возрастает и уровень марганца в крови. Подтверждением этого служит перераспределение марганца в сторону, накопление его в форменных элементах крови, что ведет к активации ферментативных процессов (табл. 12).
В ткани плаценты у рожениц с ожирением среднее количество марганца в 2,1 раза превышает контрольные показатели. Следует отметить, что на фоне общего увеличения количества марганца в организме беременной в плаценте его уровень снижается соответственно нарастанию тяжести ожирения.
Данные исследований А. А. Озол (1960) свидетельствуют, что марганец способен депонироваться в плаценте. Можно предположить, что при ожирении I и II степеней уровень марганца в крови матери снижается вследствие депонирования в плаценте. Это оказывает влияние на количество марганца в крови плода. При ожирении III степени плацента теряет способность кумулировать марганец, часть его переходит к плоду, а часть циркулирует в крови матери.
В цельной крови плодов основной группы среднее содержание марганца в 2 раза выше, чем в контроле. Раздельное определение марганца в форменных элементах и плазме пуповинной крови позволило выявить перенакопление в его форменных элементах. Эти данные свидетельствуют о компенсаторной активности окислительно-восстановительных процессов в организме плода в ответ на гипоксию плаценты, возникающую вследствие расстройства маточно-плацентарного кровообращения и нарастающую по мере прогрессирования ожирения. Однако, кроме активации тканевого дыхания, оказывающего положительное влияние на развитие плода, марганец способствует быстрому росту и увеличению массы последнего. Учитывая, что в группе рожениц с ожирением средняя масса тела новорожденных на 376,6 г больше, чем в контрольной, а частота рождения крупных детей возрастает до 31,9%, можно считать, что одним из факторов, способствующих усиленному росту плода является повышение содержания марганца в крови плодов основной группы.
Изменения микроэлементного состава крови наряду с расстройствами белкового, жирового обменов и сдвигами уровня иммуноглобулинов нарастают по мере прогрессирования ожирения и свидетельствуют о критическом состоянии механизмов гомеостаза в системе мать - плацента - плод.
Снижение количества меди можно объяснить понижением активности окислительно-восстановительных процессов у лиц с ожирением, а повышение концентрации цинка и марганца носит, по-видимому, компенсаторный характер.
Нарушения количественного состава микроэлементов являются патогенетическим обоснованием для включения в диету соответствующих пищевых ингредиентов или специальных препаратов.
|
ПОИСК:
|
© ROGHDENIEREBENKA.RU, 2010-2019
При копировании материалов активная ссылка обязательна:
http://roghdenierebenka.ru/ 'Беременность, рождение и первые годы жизни ребёнка'
При копировании материалов активная ссылка обязательна:
http://roghdenierebenka.ru/ 'Беременность, рождение и первые годы жизни ребёнка'