
Влияние ожирения рожениц на состояние плода и новорожденного
Ожирение рожениц приводит к изменениям в обмене веществ, что в свою очередь влияет на состояние плода и новорожденного. Так, масса тела новорожденных и количество подкожного жира у них зависит от степени ожирения матери (Н. В. Дмитриева и соавт., 1980; Л. М. Берштейн и соавт., 1980). По данным И. М. Медведевой и соавторов (1983), 75 крупных плодов из 100 рождаются от матерей с ожирением. В целом частота рождения крупных плодов у женщин с ожирением колеблется от 11,6 до 67% (В. И. Ямпольская, 1972; М. С. Овсепян, 1979; Sands, 1962). Причем по мере нарастания степени ожирения частота рождения крупных детей и масса тела их увеличиваются. По нашим данным, среди 611 новорожденных от 609 рожениц с ожирением частота рождения крупных плодов (масса 4000 г и более) составила 30,9%, а частота гигантских (масса 5000 г и более) - 1%. При ожирении I степени крупный плод отмечен у 28,5% женщин, при II - у 32,9%, при ожирении III степени - у 35,5%. Масса тела новорожденных составляет в среднем (3778,6±102,0) г, что на 376,6 г больше, чем у новорожденных от матерей с нормальной массой тела (табл.13).

Таблица 13. Зависимость массы тела, длины и оценки новорожденных по шкале Апгар от степени ожирения рожениц
Т. К. Набухотный и Н. В. Бразнец (1981) отмечают, что новорожденные от рожениц с ожирением II - III степени имеют, как правило, массу тела 4500 г и более, причем среди них преобладают мальчики. По нашим данным, мальчиков было 52,7%, девочек - 47,3%, в контрольной группе - соответственно 51,8 и 48,2%.
Как известно, избыточная масса тела новорожденного влияет на течение родов и является причиной целого ряда осложнений, в частности способствует увеличению продолжительности родов, развитию вторичной слабости родового процесса, увеличению частоты разрывов мягких тканей, присоединению инфекции родовых путей и др. Крупный плод является одной из причин внутричерепных травм, повреждений плечевого пояса и асфиксии новорожденных, что приводит к увеличению их смертности.
Отмечается склонность к нарушению функции дыхательного центра, что увеличивает опасность для жизни плода и новорожденного. По данным Т. К. Набухотного и соавторов (1981), у 61,5% новорожденных с избыточной массой тела отмечаются изменения центральной нервной системы, проявляющиеся тремором конечностей, изменением мышечного тонуса, появлением патологических глазных симптомов, признаков гипертензии, приступов цианоза; у 24% новорожденных имелись родовые травмы.
Р. К. Игнатьева (1973) отмечает, что показатель мертворождаемости в группе новорожденных с массой тела 4001 - 4500 г в 1,7 раза, с массой тела 4501 - 5000 - в 4,8 раза и с массой тела более 5000 г - в 20,3 раза выше, чем у новорожденных с массой тела 3001 - 3500 г. Показатель заболеваемости новорожденных возрастает, начиная с весовой группы 3501 г и более. Данные изучения катамнеза в течение 5 лет у детей, родившихся с избыточной массой тела, свидетельствуют о более высокой их заболеваемости по сравнению с контрольной группой.
Таким образом, имеются основания считать, что новорожденные с избыточной массой тела от рожениц с ожирением повышают риск перинатальной заболеваемости и смертности.
Основным этиологическим фактором, приводящим к развитию крупного плода, В. Я. Голота, С. А. Галицкий (1979) и др. считают избыточное, нерациональное питание в период беременности, что, как правило, наблюдается у женщин с ожирением. Данные исследований В. И. Ямпольской (1972) свидетельствуют, что при массе плода 3800 г энергетическая ценность продуктов, потребленных матерью за 1 сут, составляла 13 325,8 кДж, при массе плода 4200 г - 16 479,2 кДж, при массе 4800 г - 18 479,8 кДж. Избыточное питание беременной способствует формированию в эмбриональный период в подкожной основе повышенного количества жировых клеток, в связи с чем создается предрасположенность к аккумулированию жира и возникает гиперцеллюлярная форма ожирения плода.
По данным А. Г. Пап и соавторов (1978), почти у половины беременных с ожирением суточная энергетическая ценность пищи превышает физиологическую потребность во время беременности (10 032 - 10 868 кДж) и составляет 14 755,4 кДж в 1 сут, увеличиваясь в основном за счет избыточного потребления жиров и углеводов.
Таким образом, ожирение беременных влияет на внутриутробное развитие плода и создает предпосылки для формирования ожирения у ребенка. Кроме того, избыточная масса плода связана с нарушениями обмена липидов и марганца у беременных с ожирением. По мере увеличения в крови беременных концентрации общих липидов, эфиров, холестерина, β-липопротеидов происходит нарастание массы тела новорожденных (Е. Т. Михайленко, О. В. Кравченко, 1985). М. Г. Касабян (1979) предлагает использовать показатели состояния липидного обмена в качестве прогностического теста для определения массы плода. Стимулирующее влияние марганца на увеличение массы плода доказано исследованиями Е. П. Гребенникова (1970), А. И. Педченко (1977).
Увеличение массы плодов у рожениц с ожирением связано также с таким частым осложнением беременности (21,3% случаев), как угроза прерывания ее. Для лечения этого осложнения используют туринал и прогестерон. Туринал, оказывая анаболический эффект, вызывает достоверное увеличение массы плодов. Экспериментально доказано влияние длительного введения прогестерона на возрастание средней массы тела новорожденных. Учитывая эти данные, можно предположить, что как непосредственное применение прогестинов, так и состояние гиперпрогестеронемии, характерное для организма беременных с ожирением, являются благоприятным фоном для развития крупного плода.
Еще одним фактором, способствующим повышению массы тела новорожденных, является длительное существование зрелой плаценты с интенсивным кровотоком, истончением синцитио-васкулярных мембран и другими признаками функциональней активности клеточных элементов. Однако, наряду с этими изменениями, для плацент рожениц с ожирением характерны нарастающие по мере прогрессирования ожирения обызвествление, фиброз и склероз стромы ворсин, множественный "белый" инфаркт и другие изменения, которые нарушают процесс ароматизации нейтральных предшественников эстрогенов и приводят к уменьшению уровня эстрогенов в организме (Л. В. Тимошенко, Т. Д. Травянко, 1980). Эстрогенная недостаточность, являясь важным патогенетическим звеном в развитии перенашивания беременности, способствует увеличению массы плода, уплотнению костей его черепа, а также оказывает ряд других неблагоприятных воздействий.
Следовательно, при ожирении рожениц возникает сочетание целого ряда факторов, обусловливающих развитие крупного плода. Однако не все дети от матерей с ожирением рождаются с избыточной массой тела. Это, очевидно, связано с осложненным течением беременности у женщин с ожирением, в частности, с токсикозом беременных, развивающимся в 45,6% случаев. Изменения гомеостаза при позднем токсикозе беременных, нарушение маточно-плацентарного кровотока способствуют отставанию в развитии плода, уменьшению его массы. Нормализация массы плода в этой ситуации не дает положительного эффекта вследствие нарушения его адаптационных возможностей. Н. Г. Голего (1980) выявила явления глубокого метаболического ацидоза, выраженный гипоксический синдром, снижение резервных возможностей и компенсаторных реакций организма, а также сдвиги гомеостаза у новорожденных от рожениц с ожирением даже при удовлетворительном их состоянии и полной ликвидации последствий родового стресса на 3 - 4-е сутки жизни. Кроме того, у этих новорожденных отмечается уплотнение клеточных оболочек и снижение активности гликолитических процессов.
По данным В. И. Грищенко, А. Ф. Яковцовой (1978), перинатальная смертность составляет в среднем 1,9 - 2,9%. При ожирении рожениц этот показатель колеблется от 2,7 до 13,1%. По нашим данным, перинатальная смертность возрастает по мере прогрессирования ожирения от 4,1% при I степени до 6,5% при III степени. Среди причин перинатальной смертности ведущее место занимают родовые травмы (Я. П. Сольский, 1976). Последние у новорожденных от рожениц с ожирением наблюдаются в 4,6 - 14,2% случаев. В числе травм преобладают внутричерепные, переломы ключиц, кефалогематомы. Н. Г. Голего (1980) наблюдала явления черепно-мозговой травмы у 10% таких новорожденных; в целом состояние 40% детей было расценено как тяжелое и средней тяжести.
При анализе оценок новорожденных по шкале Апгар выявлено, что в группе у новорожденных от рожениц с ожирением средняя оценка на (1,4±0,1) балла ниже, чем в контрольной группе. Аналогичные данные приводит Н. Г. Голего (1980). Отмечается тенденция к снижению оценки по шкале Апгар с нарастанием степени ожирения.
Угроза внутриутробной гипоксии плода у беременных с ожирением отмечается в 4,1 раза чаще (P<0,001), а асфиксии новорожденных - в 6,4 раза чаще (P<0,001), чем в контрольной группе. Причем с нарастанием степени ожирения рожениц возрастают частота и тяжесть асфиксии (табл. 14).
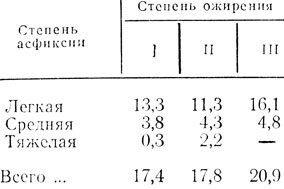
Таблица 14. Частота асфиксии новорожденных (%) в зависимости от степени ожирения рожениц
Развитию гипоксии у детей способствуют нарушения в обмене липидов и холестерина. Л. В. Квиткова, Г. А. Ушакова (1983) установили, что при повышении уровня холестерина в крови до 7,8 ммоль/л у 40% беременных с ожирением отмечен поздний токсикоз, а у 36% новорожденные были в состоянии гипоксии. При более высоком уровне холестерина осложнения наблюдаются соответственно у 76,9 и 54% беременных с ожирением. По мнению авторов, высокая концентрация холестерина в крови ведет к отложению его в стенках сосудов плаценты, что влечет за собой нарушение маточно-плацентарного кровообращения, развитие гипоксии новорожденных.
Снижение уровня окислительно-восстановительных процессов в плаценте и глубокие морфофункциональные изменения в ней, особенно при тяжелых степенях ожирения, неблагоприятно влияют на развитие плода, способствуют возникновению его гипоксии и внутриутробной гибели (А. А. Багдасарян, 1979).
Условия внутриутробного развития сказываются и на адаптационных возможностях новорожденных. В среднем дизадаптационный синдром встречается у новорожденных от рожениц с ожирением в 10,1 раз чаще, чем у новорожденных контрольной группы (P<0,001). Состояние дизадаптации проявляется в изменении мышечного тонуса и снижении рефлексов, появлении цианоза, петехий, тремора, нарушении общего состояния. Можно предположить, что состояние дизадаптации вызывается нарушениями обмена белков, липидов, микроэлементов. Так, у новорожденных от рожениц с ожирением, наряду с дефицитом белка - (54,5±0,1) г/л - отмечается гипоальбуминемия, относительная и абсолютная - (51,0±0,8) г/л. Одновременно наблюдается увеличение α2, β- и γ-глобулинов и уменьшение α1-глобулинов. Диспротеинемия, прогрессирующая по мере нарастания ожирения у рожениц, свидетельствует о напряженности белкового обмена у новорожденных, способствует снижению у них адаптационных возможностей и развитию целого ряда патологических состояний.
Жировой обмен у рожениц с ожирением и у их новорожденных характеризуется повышением концентрации фосфолипидов соответственно до 3,32 ммоль/л и 1,19 ммоль/л, общего холестерина - до 6,9 ммоль/л и 2,7 ммоль/л, общих липидов - до 8,5 г/л и 3,1 г/л. Наряду с этим снижается уровень α-липопротеидов и повышается уровень β-липопротеидов. Содержание кетоновых тел в крови новорожденных увеличивается с 2 до 4 ЕД. Эти изменения свидетельствуют о метаболической дизадаптации у новорожденных от рожениц с ожирением, являющейся результатом антенатальной гипоксии. Дизлипидемия является фоном, обусловливающим патологическое течение антенатального и интранатального периодов, что ведет к функциональным и органическим изменениям ряда органов и систем плода, осложненному течению периода новорожденности, высокой перинатальной смертности.
По данным К. Б. Акунц, Э. М. Амбарцумян (1982), повышение концентрации холестерина в крови свидетельствует о дистрофических изменениях печени с синдромом цитолиза или холестаза. Причем по мере прогрессирования ожирения морфо-функциональные изменения печени усугубляются. Выявление в пуповинной крови специфических печеночных ферментов - гистидазы, урокининазы, отсутствующих в норме и появляющихся только при поражении печеночной паренхимы, подтверждает факт внутриутробного поражения печени новорожденных от матерей с ожирением (К. Б. Акунц и соавт., 1983). Вышеотмеченная фетопатия ведет к развитию дизадаптационного синдрома у 80% новорожденных, ухудшает процессы белкового синтеза, способствует формированию крупных плодов.
Сдвиги гомеостаза в организме новорожденных от рожениц с ожирением усугубляются за счет изменений в составе микроэлементов. Так, если у новорожденных контрольной группы медь концентрировалась преимущественно в форменных элементах крови, где ее содержание в 4 раза превышает уровень в плазме, то у новорожденных от рожениц с ожирением наряду с гипокупремией отмечается выравнивание этих показателей за счет перехода меди из форменных элементов крови в плазму. Перераспределение меди усиливается по мере прогрессирования ожирения. Учитывая влияние меди на процессы окислительного фосфорилирования, обмен белков, иммунобиологическую устойчивость организма и др., можно предположить, что дискупремия новорожденных способствует снижению резервных возможностей организма и возникновению дизадаптационного синдрома.
Особое внимание привлекают изменения иммунобиологической реактивности у новорожденных от рожениц с ожирением. У них выявлено раннее возбуждение иммуногенеза, которое способствует быстрому истощению функции иммунной системы, что приводит к увеличению заболеваемости и смертности новорожденных.
Расстройство материнско-плодового кровотока, дегенеративные изменения наряду с пролиферативными и регенеративными процессами в плаценте рожениц с ожирением; также оказывают влияние на развитие плода и состояние новорожденного.
К моменту выписки из стационара (на 8-е сутки) у 61,1% новорожденных не восстанавливается первоначальная убыль массы тела. В контрольной группе не восстанавливается первоначальная убыль массы тела ко дню выписки (на 5 - 6-е сутки) у 56,0% новорожденных.
Максимальное снижение массы тела у всех новорожденных происходит на 3-и сутки. У новорожденных от рожениц с ожирением это снижение на 23 г больше, чем в контрольной группе, и составляет (5,0±0,14)% от массы тела. Такая потеря массы тела новорожденных, по данным И. С. Цыбульской (1965), И. П. Елизаровой (1977), связана с влиянием хронической гипоксии во время внутриутробного развития. При выписке из стационара средняя масса тела новорожденных от рожениц с ожирением составляла (3734±46,4) г, новорожденных контрольной группы - (3380±37,1) г. Следовательно, новорожденные от рожениц; с ожирением выписываются с невосстановленной первоначальной убылью массы тела на (41,0±5,5) г, новорожденные контрольной группы - на (29,6±10,0) г. При ожирении III степени величина невосстановленного первоначального снижения массы тела новорожденных повышается до (43,8±21,4) г. Нарушения в восстановлении первоначальной массы новорожденных от рожениц с ожирением можно объяснить поздним прикладыванием детей к груди (в среднем на 3-и сутки).
Приведенные данные свидетельствуют о неблагоприятном влиянии ожирения беременных на развитие плода и новорожденного. Поэтому новорожденные от рожениц с ожирением должны находиться в палатах интенсивного наблюдения в течение первых 3 сут, независимо от оценки их состояния при рождении. Внутриутробное поражение печени у новорожденных от рожениц с ожирением, длительно сохраняющееся состояние выраженного метаболического ацидоза, сдвиги со стороны белкового, липидного обменов способствуют развитию дизадаптационного синдрома и требуют проведения соответствующей терапии сразу после рождения и в первые 2 - 3 сут, даже при условии удовлетворительного состояния новорожденных. В комплекс терапии входят ингаляции увлажненного кислорода, внутривенное введение 20 мл 10% раствора глюкозы, 2 мл 10% раствора кальция глюконата, 10 мг цитохрома С, 25 мг кокарбоксилазы, 0,3 мл 2,4% раствора эуфиллина, 0,5 мл 5% раствора аскорбиновой кислоты, прием глютаминовой кислоты из расчета 0,1 г на 1 кг массы тела в 1 сут.
Для ликвидации метаболических и гемодинамических расстройств предложен реанимационный раствор для новорожденных, состоящий из глюкозы - (1±0,5) г, сорбита - (0,3±0,1) г, ксилита - (0,25±0,05) г, маннита - (0,15±0,05) г, 20% раствора альбумина - (10±5) мл, аминопептида - (10±5) мл, калия хлорида - (0,03±0,01) г, магния хлорида - (0,03±0,01) г, натрия гидрокарбоната - (0,4±0,1) г, тиамина хлорида - (0,0002±0,0001) г, рибофлавина - (0,0004±0,0001) г, пиридоксина гидрохлорида - (0,0001±0,00005) г, воды для инъекций - до 100 мл. Раствор вводится из расчета 40 мл на 1 кг массы тела (разовая доза) и обеспечивает нормализацию кислотно-основного состояния и энергетического баланса, детоксикацию, восполнение дефицита белка, ликвидацию гиповолемии. При появлении расстройств дыхания можно использовать гипербарическую оксигенацию в течение 1 ч.
Лечебно-профилактические мероприятия у новорожденных от рожениц с ожирением проводят под контролем не только общепринятых биохимических методов исследования (определение общего белка и белковых фракций, кислотно-основного состояния, липидов, глюкозы крови), но и иммунологического статуса новорожденного.
Единственным признаком инфицирования плода, появляющимся задолго до клинических проявлений заболевания, является повышение уровня иммуноглобулинов M в крови новорожденных (Ю. П. Резников, 1975). Концентрация иммуноглобулинов M, превышающая обычную в 3 и более раза, является признаком неонатального сепсиса. Многие авторы рассматривают низкий уровень иммуноглобулинов G у новорожденных как фактор, способствующий возникновению интеркуррентных заболеваний, а высокую концентрацию иммуноглобулинов A - как свидетельствует раннему возбуждению аппарата иммуногенеза новорожденного с быстрым последующим истощением его функции. Это ведет к сдвигам адаптационного характера и повышенной заболеваемости данной группы детей.
Таким образом, определение иммуноглобулинов A, M, I G позволяет произвести раннюю диагностику и установить I предрасположенность новорожденных к ряду заболеваний. Основным методом определения иммуноглобулинов является метод радиальной иммунодиффузии в геле по Mancini. Ю. П. Резников (1975) предположил латекс-агглютинационный тест, который в отличие от иммунодиффузного метода позволяет сократить время определения иммуноглобулинов от 3 сут до 2 - 3 мин.
Коррекция нарушений производится путем включения в I лечебный комплекс препаратов типа у-глобулина, пентоксила и др. Особо показано введение у-глобулина и антистафилококковой плазмы, поскольку большие дозы антибиотиков, назначаемые при клинических признаках внутриутробной инфекции, оказывают иммунодепрессивное действие, что способствует генерализации инфекционно-воспалительного процесса (Ю. П. Резников, М. Н. Ярцев, 1976). Проведение с первых дней жизни заместительной иммунотерапии предупреждает заболеваемость у этих новорожденных.
Наличие метаболических, иммунологических нарушений у новорожденных от рожениц с ожирением требует комплексной их коррекции. Эти новорожденные относятся к I группе повышенного риска и нуждаются в диспансерном I наблюдении после выписки из родильного дома.
|
ПОИСК:
|
© ROGHDENIEREBENKA.RU, 2010-2019
При копировании материалов активная ссылка обязательна:
http://roghdenierebenka.ru/ 'Беременность, рождение и первые годы жизни ребёнка'
При копировании материалов активная ссылка обязательна:
http://roghdenierebenka.ru/ 'Беременность, рождение и первые годы жизни ребёнка'