
Глава 2. Гормональные и метаболические взаимоотношения матери, плода и новорожденного при сахарном диабете
Особенности гормональных и метаболических взаимоотношений в системе мать - плод при неосложненном течении сахарного диабета
Благодаря успехам эндокринологии в настоящее время достаточно подробно изучена ведущая роль эндокринной системы в становлении компенсаторно-приспособительных реакций организма Известно, что при активной мобилизации гормонов создаются условия для синтеза ферментов, изменяющих направление и скорость обменных процессов в клетках эффекторных органов, и в то же время при низком уровне гормонов тормозится выработка соответствующих ферментов, что препятствует необходимой перестройке обмена веществ, лежащей в основе механизмов адаптации, в связи с этим обязательной предпосылкой для решения основной задачи акушерской диабетологии - сохранения здоровья больной сахарным диабетом матери и ее ребенка - является ясное представление об особенностях их гормонально-метаболического статуса.
Однако, несмотря на повышенный интерес к изучению этого вопроса, до настоящего времени в литературе имеется недостаточное число работ, освещающих особенности гормонально-метаболических процессов у больных сахарным диабетом беременных рожениц, их плодов и новорожденных в их взаимосвязи. Между тем плод как важнейший элемент единой функциональной системы мать - плод не только подвергается воздействию гормонально-обменных нарушении, происходящих в организме больной матери, по и сам оказывает на них определенное влияние. Таким образом, необходимость изучения взаимосвязи между организмами матери и плода для выяснения характера адаптивных реакций больной сахарным диабетом матери и ее ребенка не вызывает сомнений.
Исходя из опыта своих предыдущих исследований, мы считаем наиболее рациональным поэтапное решение этой задачи: I этап - предварительное изучение функционального состояния важнейших эндокринных систем и отдельных видов обмена веществ у здоровых и больных сахарным диабетом беременных, рожениц, их плодов и новорожденных; II этап - создание на основе полученных данных общей схемы гормонально-метаболических взаимоотношений больных сахарным диабетом матерей и их детей как при неосложненном течении беременности и родов, так и при наличии осложнений у матери (диабетическая микроангиопатия, декомпенсация заболевания) или плода (острая интранатальная гипоксия).
Для этого с помощью готовых наборов было проведено радиоиммунологическое определение содержания гормонов: иммунореактивного инсулина (ИРИ), С-пептида и соматотропного гормона (СТТ) - с помощью наборов РИА (Венгрия) и фирмы "Byk-Mullinbrodt" (ФРГ); адренокортикотропного гормона (АКТГ), кортизола и альдостерона в моче - фирмы "Cea-Ire-Sorin" (Франция), глюкагона - фирмы "DRG" (США), циклического аденозинмонофосфата (цАМФ) - фирмы "Amersham" (Англия). Уровень адреналина, норадреналина, дофамина и ДОФА в крови и моче определяли по методу, предложенному Э. Ш. Матлиной п соавт., с измерением флюоресценции на приборе МРГ-2А фирмы "Hitachi" (Япония). Содержание глюкозы и мочевины в плазме крови и суточной моче устанавливали ортотолуидиновым методом с помощью наборов Био-Ла-Тест. Для определения липидов в плазме крови использовали метод тонкослойной хроматографии на закрепленном слое силикагеля фирмы "Wolm" (ФРГ).
Состояние аминокислотного спектра в плазме крови и околоплодных водах изучали с помощью метода высоковольтного электрофореза с последующей хроматографией на аминокислотном анализаторе фирмы "Hitachi" (Япония). Показатели белкового спектра определяли методом электрофореза на бумаге, концентрацию K+ и Na+ в плазме крови и эритроцитов в суточной моче - методом плазменной фотометрии на аппарате фирмы "Southern Analytical" (США). Для определения осмолярности плазмы и мочи применяли криоскопический метод Уессона в модификации А. Г. Гинецинского и соавт.
Особенности функционального состояния инсулярного аппарата у больных сахарным диабетом матерей и их плодов. Основным анаболическим гормоном организма, способствующим утилизации глюкозы и биосинтезу гликогена, липидов и белков, является инсулин. Вследствие этого при относительной или абсолютной недостаточности в организме инсулина, которая является важнейшим патогенетическим моментом в развитии сахарного диабета, отмечается нарушение и соответствующих видов обмена веществ. Так, под влиянием вызванного инсулиновой недостаточностью нарушения ферментативных процессов резко усиливается дефосфорилирование глюкозо-6-фосфата, тормозится переход глюкозы в жиры, резко снижается синтез гликогена. Все это приводит к увеличению содержания глюкозы в крови и уменьшению запасов гликогена в тканях.
Характерные для инсулиновой недостаточности нарушения жирового обмена выражаются в уменьшении образования жиров из углеводов, снижении ресинтеза триглицеридов из жирных кислот, усилении липолитического эффекта СТГ и АКТГ, которые в физиологических условиях подавляются инсулином. При этом повышается выход из жировой ткани в кровь свободных жирных кислот и уменьшается отложение в ней жира.
Часть циркулирующих в крови свободных жирных кислот (СЖК) ресинтезируется в печени в триглицериды (ТГ), что способствует развитию жировой дистрофии печени, а при нарушении синтеза липокаина начинается интенсивное образование кетоновых тел и развивается гиперхолестеринемия. В связи с ослаблением стимулирующего влияния инсулина на энзиматические системы белкового синтеза и снижением уровня энергетического обмена уменьшается синтез белка и усиливается образование углеводов и жиров из аминокислот (глюконеогенез).
По мнению многих исследователей, беременность способствует повышению резистентности тканей к инсулину, в связи с чем неоднократно обращалось внимание на диабетогенное влияние беременности. По данным И. А. Калите и У. Т. Лейснер (1977), Г. А. Илюшиной (1977), Е. К. Конради и О. Ф. Матвеевой (1977), из обследованных во время беременности здоровых женщин соответственно у 24, 11,2 и 16% был выявлен диабетический тип кривой теста толерантности к глюкозе (ТТГ).
В то же время при тщательном анализе кривых ТТГ, проведенном у здоровых беременных в динамике Lind и соавт. (1973), а также Kühl (1975), существенных отклонений от стандартов не обнаружено. По мнению Kühl (1975), к концу беременности отмечается некоторое запаздывание подъема гликемической кривой и более высокий максимальный уровень гликемии, который, однако, не превышал пределы физиологических изменений.
В исследовании Gillmer и соавт. (1975) было показано, что при физиологически протекающей беременности уровень гликемии обычно не превышает 3,6 - 4,2 ммоль/л (65 - 75 мг%), а по данным Kalhan и соавт. (1979), у здоровых беременных уровень глюкозы в крови даже ниже, чем вне беременности. Gabbe и Mestman (1977) высказали предположение о том, что плод не только способствует уменьшению запасов глюкозы у матери, но и ограничивает способность материнского организма синтезировать глюкозу.
Согласно наблюдениям Picard и соавт. (1968), с наступлением беременности содержание инсулина в крови здоровых женщин существенно не изменяется. Однако большинство авторов [Клюкина Г. А., 1977; Комаров Е. К., 1978; Kühl, Holst, 1976; Fischer ct al., 1980] отмечали при физиологически протекающей беременности повышение уровня ПРИ натощак, а также более высокий, чем у небеременных, его подъем после нагрузки глюкозой.
Анатомической предпосылкой содержания гиперинсулинизма беременных можно считать экспериментально установленную Aerts и van Assche (1975), van Assche (1975) гиперплазию β-клеток поджелудочной железы. Отсутствие при наличии гиперинсулинизма беременных достоверных изменений в содержании глюкозы, но мнению Е. К. Комарова (1978), свидетельствует о том, что выявленный у здоровых беременных гиперинсулинизм представляет собой компенсаторную реакцию, направленную на обеспечение нормальной ассимиляции глюкозы в условиях повышенной резистентности тканей к инсулину. Dempe и соавт. (1979) установили, что нарушения секреции инсулина у беременных встречаются почти в 4 раза реже, чем изменения толерантности к глюкозе, а согласно наблюдениям Moore et al. (1981), число рецепторов к инсулину у беременных не уменьшается.
Таким образом, можно согласиться с мнением Т. А. Илюшиной (1977) и Coustam (1975) о том, что беременность не является диабетогенным фактором, однако у женщин с наследственной неполноценностью инсулярного аппарата она может способствовать нарушению толерантности к углеводам. У беременных, больных сахарным диабетом, отмечается более высокий, чем у здоровых, базальный уровень ИРИ [Cole et al., 1970; Daniel et al., 1974, и др.], что соответствует данным, полученным при обследовании больных сахарным диабетом вне беременности [Славнов В. Н. и др., 1981; Мазовецкий А. Г. и др., 1980; Баранов В. Г. и др., 1982].
Однако по вопросу о реакции инсулярного аппарата на нагрузку глюкозой у здоровых и больных сахарным диабетом беременных мнения исследователей расходятся. Kalkhoft и соавт. (1964), Carrington и McWilliams (1966) выявили у страдающих сахарным диабетом беременных усиление секреторной активности β-клеток поджелудочной железы. В то же время Daniel и соавт. (1974) не обнаружили различий между компенсаторной активностью инсулярного аппарата у здоровых и больных сахарным диабетом беременных. Jen и соавт. (1970), Samaan и соавт. (1971) опубликовали данные, свидетельствующие о наличии у последних замедленной и ослабленной реакции на нагрузку глюкозой. Уровень неподавляемой инсулиноподобной активности при сахарном диабете не отличался от такового у здоровых беременных [Harington et al., 1981] и увеличивался по мере прогрессирования беременности.
Такая противоречивость данных литературы скорее всего обусловлена неоднородным составом обследуемых больных. Кроме того, нельзя не принимать во внимание и то обстоятельство, что циркулирующие в крови у леченных инсулином беременных противоинсулиновые антитела и длительно сохраняющие свою иммунологическую активность продукты распада экзогенного инсулина могут служить источником ошибок при радиоиммунологическом определении содержания ИРИ [Мазовецкий А. Г. и др., 1980; Князев Ю. А. и др., 1981]. В связи с этим в настоящее время для более адекватной оценки инсулярных резервов организма и величины остаточной секреции инсулина применяют определение С-пептида [Мазовецкий А. Г. и др., 1980; Князев Ю. А. и др., 1981; Meistas et al., 1981], связывающего в молекуле проинсулина две цепи инсулина (A и B).
Превращение проинсулина в инсулин сопровождается освобождением C-пептида, который, не вступая в реакцию с антителами, поступает в кровь в эквимолярных с инсулином соотношениях. Значительное количество C-пептида обнаружено при вновь выявленном диабете [Madsbad et al., 1980] при стабильном течении заболевания [Luttermann et al., 1981] и при диабете взрослых [Kajinuma et al., 1979], в то время как при ювенильном диабете и лабильном течении заболевания C-пептид в крови у больных отсутствует. По мнению Vialettes и Vague (1980), при наличии в крови C-пептида (сохранена остаточная секреция инсулина) диабет протекает более стабильно, отсутствует кетоацидоз, а компенсация заболевания достигается с помощью менее высоких доз инсулина.
Согласно современным представлениям, поджелудочная железа плода начинает функционировать относительно рано. Так, наличие инсулина в тканях поджелудочной железы плода выявлено уже на 8 - 9-й [Adam et al., 1969; van Assche, 1976J, а в амниотической жидкости - на 13-й неделе развития [Weiss, 1979]. По мере увеличения срока беременности содержание ПРИ в околоплодных водах повышается и к 41-й неделе достигает 13,98 мкЕД/мл [Greco et al., 1980]. При этом доказанное Е. К. Комаровым (1978), Spellary и соавт. (1964), Keller и Krohwer (1968), Paterson и соавт. (1968) отсутствие трансплацентарного перехода инсулина от матери к плоду свидетельствует о фетальном генезе обнаруженного в околоплодных водах ПРИ. Подтверждением этой точки зрения могут служить и отсутствие корреляционной зависимости между уровнем инсулина у матери и плода [Комаров Е. К., 1978], а также исчезновение инсулина из амниотической жидкости после антенатальной гибели плода [Пономарев А. И., 1978; Greco et al., 1980].
По данным Т. К. Шевченко (1982), при физиологически протекающей беременности уровень ПРИ в пуповинной крови плода несколько ниже такового у матери, хотя в исследованиях Е. К. Комарова (1978) существенной разницы между ними обнаружено не было. Наличие у здоровых плодов высокого уровня инсулинемии, соответствующего таковому в организме взрослого, обусловлено, по мнению Hendries и соавт. (1981), высоким сродством рецепторов эритроцитов крови пуповины к инсулину.
Что касается исследования в крови здоровых плодов C-пептида, то по этому вопросу в литературе имеются лишь единичные сообщения. Установлено, что C-пептид переходит через плаценту в незначительном количестве.
О наличии в околоплодных водах здоровых беременных C-пептида сообщали Chi-Cha-Lin и соавт. (1981), которые выявили прямую корреляционную связь между уровнем C-пептида и массой новорожденного. В связи с этим авторы рекомендуют при подозрении на гипотрофию плода определять содержание C-пептида в околоплодных водах и проводить лечение этой патологии под контролем уровня C-пептида. С нашей точки зрения, в связи с тем, что в настоящее время широкое распространение получил метод ультразвукового сканирования, это предложение является нерациональным.
На основании результатов патоморфологических исследований Е. П. Романовой и Л. М. Болховитиновой (1961), Kloos (1952), Aultquist (1976), van Assche и соавт. (1971, 1975), изучения инсулиновой активности крови [Савченко Т. Н., 1974; Baird, Farquhar, 1962], определения в крови и амниотической жидкости плодов при сахарном диабете матери уровня иммунореактивного инсулина [Второва В. Г. и др., 1976; Кондратович Л. Н. и др., 1982; Pedersen et al., 1974; Persson et al., 1976; Tihebroutsky et al., 1980] можно сделать заключение о наличии у потомства больных сахарным диабетом матерей внутриутробно развившейся индуцированной инсулярной гиперактивности. Этому, по мнению Х. Бибергайля (1977), способствует более раннее созревание β-клеток их поджелудочной железы.
Свидетельством напряженной функциональной активности фетальных (3-клеток новорожденных при наличии сахарного диабета у матери является также выявленная в исследованиях Fisber и соавт. (1980), John и соавт. (1981) значительно более резкая и быстрая, чем у потомства здоровых женщин, реакция островкового аппарата поджелудочной железы на действие различных раздражителей. Oakley и соавт. (1972) после введения больным сахарным диабетом роженицам глюкозы наблюдали у плодов значительное увеличение инсулина (на 200 - 900% от исходного уровня).
Установлено, что в крови новорожденных, матери которых в течение длительного времени получали инсулин, циркулирует значительное количество противоинсулиновых антител. Это, по мнению Е. Педерсена (1979), значительно затрудняет правильное определение уровня фетального инсулина. В связи с этим для более адекватной оценки функциональных резервов инсулярного аппарата у потомства больных сахарным диабетом матерей в последние годы все чаще применяют определение C-пептида.
Однако единой точки зрения относительно диагностической ценности определения C-пептида в литературе пока нет. Так, при сравнительном анализе содержания C-пептида у новорожденных от здоровых и больных сахарным диабетом матерей Phelps и соавт. (1978) существенной разницы между этими показателями не выявили, хотя авторы обратили внимание на повышение при сахарном диабете коэффициента C-пептид/глюкоза и на значительно более быстрое, чем в контроле, его увеличение в ответ на внутривенное введение глюкозы. Наряду с этим существуют исследования [Block et al., 1974; Jokosuka et al., 1980], свидетельствующие о высоком уровне C-пептида в крови и околоплодных водах [Eschvege, 1980] новорожденных, матери которых больны сахарным диабетом.
Проведенные нами исследования функционального состояния инсулярного аппарата здоровых и больных сахарным диабетом беременных позволили установить у последних более высокое содержание ПРИ. В общей группе больных сахарным диабетом, составленной без учета тяжести заболевания, уровень ИРИ при сроке беременности 36 - 38 нед достигал 19,4±3,6 мкЕД/мл, а у здоровых женщин с тем же сроком беременности он был равен 11,04±2,4 мкЕД/мл. Однако в связи с большими колебаниями в содержании гормона различия между этими группами беременных оказались недостоверными (P>0,05).
В то же время при неосложненных родах содержание ИРИ в общей группе рожениц, больных сахарным диабетом, более чем в 2 раза превышало таковое в контрольной, при этом у рожениц с ИЗД уровень ИРИ достигал 41,42±8,34 мкЕД/мл (292% по отношению к принятому за 100% уровню в контрольной группе), а при ИНЗД составил 22,34±4,5 мкЕД/мл (157%).
Однако при параллельном определении содержания С-пептида в контрольной и исследуемой группах рожениц было установлено, что более высокий уровень ИРИ в крови у больных сахарным диабетом рожениц нельзя во всех случаях рассматривать как проявление высокой секреции этого гормона, так как у здоровых рожениц содержание C-пептида оказалось несколько выше, чем в общей группе рожениц, больных сахарным диабетом. При этом наиболее низкий уровень C-пептида был отмечен у больных ИЗД - 2,91±0,7 нг/мл (83%), в то время как у рожениц с ИНЗД отмечалась тенденция к его повышению - 3,64±0,7 нг/мл (105%).
Для изучения реакции инсулярного аппарата рожениц, больных сахарным диабетом, на родовой стресс у больных с одинаковой тяжестью заболевания был проведен сравнительный анализ содержания ИРИ в зависимости от способа родоразрешения. Более высокое содержание ИРИ обнаружено у рожениц, родоразрешение у которых проведено оперативным путем - (51,42±17,24 мкЕД/мл при ИЗД и 33,6±12,1 мкЕД/мл при ИНЗД). Тем не менее выявленное при родах через естественные родовые пути снижение содержания ИРИ не следует рассматривать как полное отсутствие реакции инсулярного аппарата на родовой стресс, так как оно в известной степени может быть обусловлено особенностями течения и ведения родов у этих больных.
Значительная физическая нагрузка нередко приводит к снижению во время родов уровня гликемии, что в свою очередь тормозит поступление в кровь эндогенного инсулина. Кроме того, для предупреждения у рожениц тяжелых гипогликемических состояний основную утреннюю дозу вводимого им в день родоразрешения инсулина обычно резко уменьшают. С этой же целью при абдоминальном родоразрешении введение инсулина осуществляют одновременно с инфузионной терапией перед началом кесарева сечения, что может способствовать повышению уровня ИРИ в момент извлечения ребенка, т. е. к моменту взятия крови для исследования.
Уровень C-пептида при абдоминальном родоразрешении больных сахарным диабетом рожениц составил 2,61±0,78 нг/мл при ИЗД и 3,06±1,03 нг/мл при ИНЗД. Таким образом, при более адекватном определении секреции инсулярного аппарата прослеживается определенная, хотя и слабовыраженная тенденция к его более значительной активации в ответ на родовой стресс.
Согласно нашим наблюдениям, уровень ИРИ и С-пептида в пуповинной крови в общей группе детей, рожденных в удовлетворительном состоянии при неосложненных родах через естественные родовые пути от матерей, больных сахарным диабетом, достигает соответственно 41,71±5,11 мкЕД/мл и 3,32±0,84 нг/мл, что составляло 336 и 264% по отношению к показателям здоровых плодов, принятых за 100%. Выявленные соотношения сохраняются и при расчете уровня гормонов на 1 кг массы тела ребенка (соответственно 231 и 233% при сахарном диабете матери и 100% в контроле), который был проведен с целью нивелировать возможные различия в показателях, зависящие от того, что масса тела плодов в исследуемых группах была неодинаковой.
Полученные данные позволяют сделать заключение о том, что вне зависимости от массы тела ребенка содержание ИРИ и C-пептида у плодов, рожденных от матерей с ИЗД, был достоверно выше - соответственно 52,05±6,96 мкЕД/мл (155%) и 4,99±1,4 нг/мл (342%). Это свидетельствует об истинной гиперактивности их инсулярного аппарата.
Обращает на себя внимание различная реакция инсулярного аппарата плодов на родовой и эндогенный метаболический стресс, обусловленный обменными нарушениями больных сахарным диабетом матерей. Так, при аналогичной акушерской ситуации (неосложненные роды через естественные родовые пути) средний уровень ИРИ и C-пептида у плодов от матерей с ИЗД был достоверно выше, чем в пуповинной крови детей от матерей с легким течением заболевания (соответственно 155 и 342%). В то же время при одинаковой тяжести заболевания (ИЗД матери) различия в содержании ИРИ у плодов, рожденных через естественные родовые пути и извлеченных при плановом кесаревом сечении, практически отсутствовали - соответственно 52,06±6,96 и 52,23±17,23 мкЕД/мл. У плодов от матерей с более легким течением заболевания, при котором не требуется экзогенное введение инсулина, при абдоминальном родоразрешении отмечался более низкий уровень ИРИ.
Таким образом, сравнительный анализ функционального состояния инсулярного аппарата у здоровых и больных сахарным диабетом рожениц и их плодов позволил установить у последних наличие достоверно более высокого уровня ИРИ, который поднимается по мере увеличения тяжести основного заболевания матери. При этом высокое содержание в периферической крови больных ИЗД матерей ИРИ не может расцениваться как проявление достаточной функциональной активности островкового аппарата поджелудочной железы, так как оно сочеталось с низким уровнем C-пептида.
В то же время у рожениц с легким течением ИНЗД была отмечена тенденция к повышению концентрации C-пептида, что свидетельствует о наличии остаточной секреции инсулина и сохранении резервов инсулярного аппарата, однако это сопровождалось недостаточной реализацией биологического эффекта действия инсулина на клеточном уровне. Следовательно, у рожениц с сахарным диабетом имеются проявления как относительной, так и абсолютной инсулиновой недостаточности. У плодов этой группы было установлено наличие истинной гиперактивности инсулярного аппарата.
Таким образом, полученные данные подтверждают точку зрения Х. Бибергайля (1977) и В. Н. Славнова и соавт. (1977, 1981) о снижении секреторной активности инсулярного аппарата у беременных с ИЗД и показывают достоверное повышение секреции инсулина у их плодов.
Особенности функционального состояния α-клеток поджелудочной железы у больных сахарным диабетом и их плодов. Наряду с инсулярным аппаратом значительную роль в поддержании гомеостаза глюкозы играет гормон, секретируемый α-клетками поджелудочной железы, - глюкагон.
В связи с характерными особенностями функции глюкагона (стимуляция гликогенолиза и ускоренное поступление глюкозы из печени, стимуляция липолиза и катаболизма белка) он способствует поступлению глюкозы во внеклеточное пространство, в то время как под влиянием инсулина происходит переход глюкозы из внеклеточного пространства в клетки и утилизация его тканями. Стимулом для активации а-клеток и синтеза глюкагона является снижение уровня глюкозы в крови [Asson et al., 1979]. В связи с этим Gerich (1978) и Cryer (1981) считают глюкагон основным регулятором гликемии при остро возникших гипогликемических состояниях.
В условиях гипергликемии активность а-клеток подавляется и секреция глюкагона снижается, что через аденилциклазную систему стимулирует биосинтез инсулина. Таким образом, сочетанное действие α- и β-клеток поджелудочной железы обеспечивает у здоровых людей нормальный уровень глюкозы в организме.
При сахарном диабете, несмотря на высокий уровень гликемии, α-клетки продолжают инкретировать глюкагон [Lilavivathama et al., 1979; Turer et al., 1981], что способствует еще большему повышению уровня сахара в крови. Неспособность а-клеток у больных сахарным диабетом реагировать на увеличение гипергликемии снижением биосинтеза глюкагона объясняется эндогенным дефектом глюкорецепторов α-клеток, который не связан с инсулиновой недостаточностью.
Это послужило основанием для выдвижения гипотезы о бигормональном генезе сахарного диабета [Ohneda et al., 1978]. Согласно этой гипотезе, в патогенезе сахарного диабета наряду с инсулиновой недостаточностью равноценную роль играет и избыток глюкагона. Однако эту точку зрения разделяют не все исследователи [Barnes et al., 1977; Clarke et al., 1978].
Не существует единого мнения и по вопросу об уровне глюкагона у больных сахарным диабетом. По данным Л. К. Старосельцевой и соавт. (1980), Е. С. Косиловой и соавт. (1982)., у больных с различной тяжестью сахарного диабета содержание глюкагона колеблется в широких пределах с тенденцией к повышению, особенно при тяжелой форме заболевания и наличии кетоацидоза. В то же время, согласно результатам исследований В. Н. Славнова и соавт. (1978, 1981), концентрация глюкагона у больных сахарным диабетом значительно снижена. По данным Drost и соавт. (1980), существенных различий между базальной концентрацией глюкагона в крови больных сахарным диабетом и здоровых людей не существует, но у последних отмечается выраженная реакция глюкагона в ответ на развитие гипогликемического состояния, чего не происходит при сахарном диабете.
Сведения литературы о влиянии физиологически протекающей и осложненной беременности на секреторную активность а-клеток поджелудочной железы немногочисленны. Согласно наблюдениям Lebran и соавт. (1976), во время беременности отмечаются незначительные колебания базального уровня глюкагона при заметном его повышении в III триместре. После родов наступает снижение секреторной активности а-клеток [Daniel et al., 1974]. В то же время, по мнению Spellacy и соавт. (1973), Е. Педерсен (1979), в течение всей беременности и в послеродовом периоде базальная секреция глюкагона остается стабильной. Стимуляция глюкозой приводит к снижению уровня глюкагона, которое к моменту родов становится более выраженным, в то время как нагрузка белком стимулирует активность α-клеток [Luyckx et al., 1972, 1979].
Таким образом, во время беременности, как и вне ее, нагрузка глюкозой подавляет, а стимуляция аминокислотами активизирует секреторную деятельность а-клеток поджелудочной железы. У беременных отмечено также повышенное соотношение ИРИ/глюкагон, свидетельствующее о более активной базальной и стимулированной секреции инсулярного аппарата беременных [Luyckx et al., 1979]. Полученные данные позволили исследователям прийти к выводу о том, что во время беременности α-клетки поджелудочной железы менее чувствительны к действию различных раздражителей, чем β-клетки. Учитывая анаболическую направленность действия инсулина и катаболическую глюкагона, такое соотношение исследуемых гормонов можно рассматривать как известную компенсаторную реакцию, направленную на восстановление перед предстоящими родами энергетических ресурсов матери, истраченных на потребности растущего плода.
У беременных, больных сахарным диабетом, уровень глюкагонемии по сравнению с таковым вне беременности повышен. Он был также более высоким, чем у здоровых беременных [Falluca и соавт., 1979]. Согласно исследованиям Bloom и Johnston (1972), Milner и соавт. (1973), существенных различий между базальным уровнем глюкагонемии в периферической крови здоровых рожениц и пуповинной крови не выявлено. Содержание глюкагона в пуповинной крови не зависит от уровня гликемии и инсулинемии плода, но при развившейся гипоксии оно увеличивается [Johnston, Bloom, 1973].
В экспериментальных исследованиях Sadoyer-Goffaux и соавт. (1979) было установлено, что фетальные α-клетки менее чувствительны к различным раздражителям, чем β-клетки. В связи с этим в поджелудочной железе плода глюкагон накапливается медленнее, чем инсулин. Было также показано, что α-клетки поджелудочной железы здоровых плодов не чувствительны к стимуляции глюкозой и отвечают только на нагрузку аминокислотами.
Существенных различий в базальном уровне глюкагона в пуповинной крови плодов от больных сахарным диабетом и здоровых матерей выявлено не было [Bloom, Johnston, 1972]. В то же время у новорожденных при сахарном диабете матери вне зависимости от уровня их гликемии содержание глюкагона было уменьшено [Luyckx et al., 1975; Amendt P., 1978].
Полученные данные уточнены Kühl и соавт. (1977), которые изучали уровень гликемии, инсулинемии и глюкагонемии, а затем вычисляли молярное отношение ИРИ/глюкагон у новорожденных при различной тяжести и длительности диабета матери. Резюмируя результаты этой работы, Е. Педерсен (1979) пришел к заключению, что при ИЗД матери, особенно осложненного диабетическими микроангиопатиями, гиперактивность инсулярного аппарата новорожденных сопровождается гипофункцией а-клеток поджелудочной железы. Такая гипофункция является, по-видимому, следствием внутриутробного истощения α-клеток, обусловленного длительным влиянием гипергликемии матери. Кроме того, новорожденным от больных сахарным диабетом матерей свойственна также и определенная резистентность к экзогенно вводимому глюкагону [Педерсен Е., 1979]. В то же время в отличие от здоровых новорожденных α-клетки поджелудочной железы у детей больных матерей сохраняют определенную чувствительность к стимуляции глюкозой [Luyckx et al., 1972].
Как показали наши исследования, уровень глюкагона в венозной крови больных сахарным диабетом (282,79±38,9 нг/мл) был несколько выше, чем у здоровых рожениц (197,77±57,7 нг/мл), и составлял 129% по отношению к принятому за 100% уровню в контрольной группе. При этом влияние тяжести основного заболевания на секрецию глюкагона проявлялось у обследованных нами больных несколько более выраженным повышением его уровня у больных ИЗД (376,2±95,33 нг/мл при диабете, компенсируемом инсулином, и 243,9±44,86 нг/мл при отсутствии инсулинотерапии).
По нашим наблюдениям, содержание глюкагона в пуповинной крови здоровых плодов существенно не отличалось от такового у их матерей (коэффициент глюкагон матери/глюкагон плода составлял 0,97). Эти данные совпадают с результатами наблюдений S. König и соавт. (1978), которые установили, что уровень глюкагона в пуповинной крови здоровых плодов соответствует таковому в крови их матерей.
В то же время при сахарном диабете степень глюкагонемии у плода заметно ниже, чем у матери (коэффициент глюкагон матери/глюкагон плода равен 1,46). При этом в исследуемой группе было, выявлено отсутствие достоверной корреляционной зависимости между содержанием глюкагона у матери и плода (R=0,036-0,3, Fф=0,011-1,44), в то время как в контрольной группе связь между соответствующими показателями была достаточно выражена (R=0,86 и Fф=11,02).
Несколько более низкий уровень глюкагона у плодов от матерей, больных сахарным диабетом, был отмечен нами и при сравнительном анализе средних показателей содержания этого гормона (100% в контрольной группе и 93,6% в общей группе плодов от больных сахарным диабетом). При этом влияние тяжести сахарного диабета матери на содержание глюкагона в пуповинной крови плода проявляется в наличии очень слабой тенденции к несколько более высокому уровню глюкагонемии у плодов от матерей с ИЗД; 100% в контрольной группе, 95,42% при ИЗД и 91,87% при ИНЗД матери. При пересчете на 1 кг массы тела это составляло соответственно 56,26±14,1; 52,62±11,14 и 42,42±12,06 нг/мл (P>0,05). Полученные данные позволяют считать, что отсутствуют существенные различия в уровне глюкагона у плодов здоровых и больных сахарным диабетом матерей, а также выраженная реакция α-клеток плода на эндогенный метаболический стресс, обусловленный тяжелым течением основного заболевания матери.
Если учесть тесное взаимодействие глюкагона и инсулина, а также их сочетанное влияние на уровень гликемии в организме, то, исходя из высокой активности инсулярного аппарата плодов от больных сахарным диабетом матерей, можно было бы ожидать в исследуемой группе значительно более высокое содержание глюкагона, тем более что уровень глюкозы в пуповинной крови основной и контрольной групп не имеет существенных различий (4,4±0,12 ммоль/л при сахарном диабете матери и 4,3±0,17 ммоль/л в контрольной группе). В то же время при сравнительном анализе коэффициентов глюкагон/гликемия (2,59 в контрольной группе, 2,72 при ИНЗД и 2,36 при ИЗД матери) и ИРИ/гликемия (соответственно 0,16; 0,38; 0,9) обращает на себя внимание отсутствие существенных различий между показателями первого отношения, в то время как коэффициент ИРИ/гликемия при более тяжелом диабете матери выше, чем в контрольной группе в 5,6, а при ИНЗД - в 2,4 раза. Таким образом, необходимо отметить, что у плодов от больных сахарным диабетом матерей на фоне выраженного гиперинсулинизма отмечается определенная инертность а-клеток поджелудочной железы, что, возможно, связано с истощением их функциональной активности.
Особенности кортикотропной и глюкокортикоидной функции гипофизарно-надпочечниковой системы у больных сахарным диабетом и их плодов. Значительный интерес к изучению состояния гипоталамо-гипофизарно-надпочечниковой системы при беременности и в родах обусловлен не только активным участием гормонов этой системы в процессах обмена веществ, но и той важной ролью, которую играет эта система в осуществлении защитно-приспособительных реакций на появление таких стрессорных состояний, какими являются беременность и роды.
Основную роль в регуляции функции коры надпочечников играет адренокортикотропный гормон гипофиза (АКТГ), который стимулирует надпочечники, ускоряя биосинтез кортикостероидов, и повышает их использование тканями.
Физиологическая роль глюкокортикоидов заключается в том, что они способствуют повышению уровня гликемии, увеличению липолиза, изменению соотношений липопротеиновых фракций и перераспределению белка в организме, увеличению реабсорбции воды и натрия, снижению реабсорбции калия в почечных канальцах. Таким образом, глюкокортикоиды оказывают активирующее действие практически на все виды обмена веществ. Кроме того, глюкокортикоиды оказывают влияние на энергетический обмен и способствуют повышению сопротивляемости организма стрессам. Взаимодействие между АКТГ и надпочечниками осуществляется по принципу двойной обратной связи, что позволяет путем саморегуляции поддерживать в крови оптимальный уровень гормонов.
Согласно исследованиям Э. Р. Баграмян (1980), И. А. Макарова и соавт. (1981), уровень АКТГ в крови беременных не превышает соответствующие показатели этого гормона вне беременности, а по данным Carr и соавт. (1981) - даже ниже такового у небеременных. Однако в III триместре беременности Carr и соавт. (1981) отметили некоторое повышение концентрации АКТГ. На этом основании авторы высказали предположение о возможном существовании дополнительного источника биосинтеза АКТГ.
Несмотря на незначительную стимуляцию со стороны аденогипофиза, секреторная активность коры надпочечников у беременных достаточно велика, о чем свидетельствует высокий уровень кортикостероидов как в крови [Вихляева Е. М., 1969; Бунтян А. Ф. и др., 1971; Паллади Г. А. и др., 1975; Тимошенко Л. В. и др., 1981; Corbier, Roffi, 1978; Murphy, 1982], так и в околоплодных водах [Дашкевич В. Е., Травянко Т. Д., 1979; Blankstein et al., 1980]. На основании этих данных W. Holten, P. Ruekert (1981) пришли к выводу о повышенной реактивности надпочечников к регулирующему влиянию АКТГ.
В то же время И. А. Макаров и соавт. (1981), сопоставляя уровень в крови кортизола и величину его экскреции с мочой, пришли к выводу, что повышенное содержание кортизола в крови беременных является результатом недостаточной его утилизации тканями. Повышение уровня кортикостероидов во время беременности происходит за счет увеличения содержания их белково-связанных форм [Бунтян А. Ф. и др., 1971], что, по мнению Г. Я. Корнеева (1979), обусловлено повышенным содержанием у беременных эстрогенов, которые усиливают связывающую способность транскортина. При этом у беременных снижается доля свободного кортизола, уровень которого не отличается от такового вне беременности.
В то же время Ajabor и соавт. (1972), Е. Педерсен (1979) отмечали у беременных прогрессивное увеличение содержания не только кортизона, но и свободного кортизола. О высоком уровне кортизона при беременности сообщают Carr и соавт. (1981). Авторы установили, что максимальные значения уровня этого гормона наблюдаются при сроке беременности 26 нед, после чего наступает стабилизация концентрации в крови кортизона.
Влияние родового акта на функциональное состояние гипоталамо-гипофизарно-надпочечниковой системы здоровых беременных, по мнению большинства исследователей, проявляется как в выраженном повышении ее активности вообще, так и в более высоком содержании АКТГ и кортикостероидов в крови женщин, роды у которых произошли через естественные родовые пути [Бажанова Л. П., 1967; Кондратович Л. М., 1977; Nwosu et al., 1975; Vermes et al., 1979].
По данным Г. А. Паллади и соавт. (1975), в родах преобладали биологически активные формы кортикостероидов. После родов отмечается снижение уровня кортикостероидов [Бунтян А. Ф. и др., 1971, и др.].
Согласно исследованиям Рассохина А. В. и Кобозевой Н. В. (1981), концентрация фетального АКТГ с ранних сроков беременности (11 - 14 нед) выше таковой в крови взрослых и затем продолжает неравномерно повышаться. Выявлено три пика концентрации АКТГ в фетальной крови в 11 - 14 нед, 21 - 24 нед и 32 нед. После 34 нед содержание АКТГ в крови плода начинает снижаться и остается на том же уровне в течение недели после рождения ребенка [Winter, Oliver, 1974]. Следовательно, к концу беременности содержание АКТГ в пуповинной крови плода выше, чем у небеременных женщин [Furuhashi et al., 1982]. При этом установленное Dupouj и соавт. (1980) отсутствие перехода АКТГ матери через плацентарный барьер рассматривается как подтверждение фетального генеза АКТГ, определяемого в пуповинной крови. Это позволило авторам сделать заключение об относительной морфологической и функциональной зрелости аденогипофиза плода к концу беременности.
Секреторная активность надпочечников плода также начинает проявляться в ранние стадии его развития. По данным С. Е. Левиной (1976), к 8 - 9-й неделе онтогенеза происходит дифференцировка коры надпочечников на соответствующие слои. Концентрация кортикостероидов в крови плода, составляющая в 12 - 16 нед 16 нг/мл, к концу беременности достигает 132 нг/мл. Значительное увеличение содержания кортикостероидов в крови плода подтверждается также исследованиями Murphy (1973, 1982), который обнаружил троекратное его увеличение с 12-й по 37-ю неделю беременности.
Во время родов, согласно данным Л. Г. Сичинава и Н. А. Сергеевой (1977), Э. Г. Баграмян (1980), И. С. Цыбульской и соавт. (1977), Hartman и соавт. (1981), в пуповинной крови плода увеличивается концентрация кортикостероидов, что особенно выражено при родоразрешении через естественные родовые пути.
В исследовании Hartman и соавт. (1981) было показано значительное увеличение в крови плода биологически активных фракций кортизола, что, по мнению авторов, является фактором, обеспечивающим адекватную адаптацию к условиям внеутробного существования. Однако уровень фетальных кортикостероидов все же остается значительно ниже, чем у матери [Цыбульская И. С. и др., 1977; Баграмян Э. Р., 1980; Simmer et al., 1974; Hartman et al, 1981].
Более низкое, чем у матери, содержание в пуповинной крови гормонов надпочечников явилось основанием для предположения о переходе кортикостероидов во время родов от матери к плоду. Однако эту точку зрения опровергают Corbier и Roffi (1978), которые на основании экспериментальных исследований пришли к заключению об автономности гипоталамо-гипофизарно-надпочечниковой системы плода. По мнению Г. М. Савельевой (1976), значительные различия в концентрации кортикостероидов у матери и плода, а также увеличение их содержания в околоплодных водах является доказательством активации во время родов надпочечников самого плода. Об активной реакции плода на родовой стресс свидетельствует также отмеченное многими авторами более высокое содержание кортикостероидов у плодов, рожденных через естественные родовые пути.
При беременности, осложненной сахарным диабетом, E. Tolstoi и соавт. (1962), Gorskog (1964), Chattoraj и соавт. (1974) не выявили существенных различий в содержании кортикостероидов в плазме у здоровых и больных сахарным диабетом беременных. В противоположность этому Scholz и Huther (1978) обнаружили в плазме беременных, больных сахарным диабетом, более высокий, чем у здоровых, уровень кортизола и кортикостерона.
Согласно результатам исследований О. С. Сериковой и соавт. (1980), у больных с ювенильной формой сахарного диабета выявлено высокое содержание в крови кортизола, свободных 17-оксикортикостероидов (17-ОКС) в моче и низкий уровень экскреции связанных 17-ОКС, что, по мнению авторов, свидетельствует о функциональном напряжении пучковой зоны коры надпочечников и недостаточной функции печени. Особенно ярко эти изменения проявились при наличии у беременных диабетической микроангиопатии. При компенсированном течении заболевания они были менее выражены.
Во время родов, по наблюдениям Chattoraj и соавт. (1974), содержание кортизола и кортизона у больных сахарным диабетом было выше, чем у здоровых рожениц. При родах через естественные родовые пути по сравнению с абдоминальным родоразрешением было отмечено увеличение активности надпочечников плода.
Изучая особенности функционального состояния гипофизарно-надпочечниковой системы у здоровых и больных сахарным диабетом матерей, их плодов и новорожденных, Л. М. Кондратович (1977) установила у рожениц, больных сахарным диабетом, достоверно более высокое, чем в контроле, содержание всех исследуемых фракций кортикостероидов. Наряду с этим автором было выявлено, что при отсутствии обезболивания в родах, при длительности заболевания свыше 3 лет и при декомпенсации диабета содержание кортикостероидов в крови у больных рожениц достоверно повышалось, что можно расценить как проявление значительного функционального напряжения гипофизарно-надпочечниковой системы. Характерные для потомства матерей, больных сахарным диабетом, "кушингоидный" внешний вид, а также выраженная неполноценность адаптивных реакций позволяют предположить у них наличие функциональных нарушений гипофизарно-надпочечниковой системы.
Большинство исследователей, изучавших содержание кортикостероидов в крови плодов и новорожденных от больных сахарным диабетом матерей и экскрецию их с мочой, пришли к заключению о наличии у этих детей гиперкортицизма. В противоположность этому D. Aarskog (1964) не обнаружил существенных количественных различий в секреторной активности надпочечников у плодов здоровых и больных сахарным диабетом матерей.
Большой интерес представляют исследования Л. М. Кондратович (1977) по определению реакции гипофизарно-надпочечниковой системы потомства от матерей, больных сахарным диабетом, на различные эндо- и экзогенные раздражители. Недостаточная компенсация диабета матери, а также наличие диабетической микроангиопатии сопровождаются повышением уровня 11-оксикортикостероидов (11-ОКС) в крови матери и плода. Факторы, усиливающие стрессорное воздействие родового акта (отсутствие обезболивания), а также оперативные вмешательства в родах (вакуум- экстракция, акушерские щипцы, абдоминальное родоразрешение), по данным автора, способствуют повышение у детей функциональной активности гипофизарно-надпочечниковой системы.
Проведенный нами сравнительный анализ показателей функционального состояния гипофизарно-надпочечниковой системы у здоровых и больных сахарным диабетом женщин при сроке беременности 36 - 38 нед показал, что характерное для больных сахарным диабетом более высокое, чем у здоровых женщин, содержание в венозной крови кортикотропина и кортизола сохраняется и во время беременности. Так, уровень АКТГ и кортизола в крови беременных, больных сахарным диабетом, составил соответственно 89,18±21,12 и 446,75±29,9 нг/мл (в контрольной группе 53,5±15,16 и 380,9±27,3 нг/мл). При этом у беременных с ИЗД также отмечена повышенная экскреция кортикостероидов с мочой.
Снижение суточной экскреции кортикостероидов мы смогли выявить только у больных длительно протекающим осложненным диабетом. По всей вероятности, это обусловлено стимулирующим влиянием беременности на гормонально-метаболический статус больных. При неосложненных родах через естественные родовые пути содержание АКТГ и кортизола у рожениц с сахарным диабетом было несколько выше, чем в контрольной группе, и составляло соответственно 114,1±8,65 (114%) и 490,1±48,6 (118%) нг/мл.
Согласно результатам исследований Т. П. Безверховой (1978), а также Г. Г. Алексеевой и соавт. (1980), особенно высокое содержание кортизола у больных сахарным диабетом наблюдается при декомпенсации заболевания, а после достижения компенсации диабета уровень кортизола приближается к норме. Таким образом, незначительное по сравнению с контролем повышение уровня АКТГ и кортизола в исследуемой группе рожениц можно расценивать и как результат проведенной у них во время беременности и в родах адекватной инсулинотерапии.
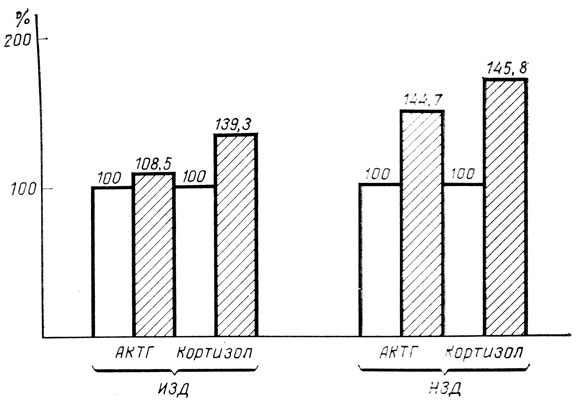
Рис. 1. Соотношение АКТГ и кортизола в пуповинной крови плодов в зависимости от способа родоразрешения и тяжести сахарного диабета матери. Светлые столбики - показатели при родоразрешении путем планового кесарева сечения; заштрихованные - через естественные родовые пути
При анализе содержания гормонов гипофиза и коры надпочечников в зависимости от тяжести диабета у рожениц с легким течением ИНЗД была выявлена заметная тенденция к его увеличению: уровень АКТГ и кортизола в этой группе составил 125,9±30,5 и 505,2±90,5 нг/мл (129,3 и 105% по сравнению с принятыми за 100% показателями у рожениц ИЗД (рис. 1). Аналогичные результаты были получены и Л. М. Кондратович (1977), которая изучала у рожениц, больных сахарным диабетом, а также их плодов и новорожденных состояние глюкокортикоидной функции надпочечников. Согласно полученным автором данным, у рожениц с легким течением заболевания содержание 11-ОКС было достоверно выше, чем в контрольной группе; при тяжелом течении заболевания уровень этого гормона приближался к таковому в контрольной группе.
В то же время при одинаковой тяжести сахарного диабета у обследованных нами рожениц выявлена отчетливая тенденция к повышению уровня АКТГ и кортизола при родоразрешении через естественные родовые пути - соответственно 97,37±13,52 и 480,9±56,6 нг/мл (109,6 и 134,8% по отношению к принятому за 100% уровню этих гормонов у больных ИЗД, родоразрешение которых произведено абдоминальным путем).
Таким образом, стрессорное влияние родовой деятельности у больных сахарным диабетом, как и у здоровых рожениц, приводит к компенсаторной активации гипофизарно-надпочечниковой системы. Однако обусловленные применением различных методов родоразрешения различия в уровне АКТГ и кортизола при сахарном диабете заметно меньше, чем в аналогичных группах здоровых женщин. Так, согласно исследованиям Э. Р. Баграмян (1980), концентрация АКТГ и кортикостероидов у женщин, родоразрешение которых произведено абдоминальным путем, составляет всего 45,5 и 43,3% по отношению к принятым за 100% показателям при родах через естественные родовые пути.
С нашей точки зрения, такое противоречие может быть объяснено двумя обстоятельствами: определенной инертностью и истощением у больных гипофизарно-надпочечниковой системы, которая не в состоянии адекватно реагировать на родовой стресс, и большей частотой медикаментозного родовозбуждения у больных.
Как показали результаты проведенных исследований, в общей группе плодов от больных сахарным диабетом матерей содержание АКТГ и кортизола было выше, чем в контрольной группе, и составило соответственно 100,1±17,5 и 327,65±15,3 нг/мл (121,6 и 130,2% по отношению к принятым за 100% показателям плодов от здоровых матерей). Однако при пересчете на 1 кг массы тела ребенка различия в содержании кортизола в пуповинной крови плодов от здоровых и больных сахарным диабетом матерей почти нивелировались (соответственно 81,92±9,85 и 88,11±5,24 нг/мл). Таким образом, выраженного гиперкортицизма, описанного в литературе, мы у обследованных нами детей выявить не смогли.
Влияние тяжести заболевания матери на кортикотропную и глюкокортикоидную активность эндокринной системы плода проявилось в наличии определенных различий в соответствующих показателях у плодов от матерей с ИЗД и ИНЗД. При этом у последних концентрация АКТГ и кортизола достигала 103,58±26,8 и 349,7±33,4 нг/мл, в то время как при более тяжелом диабете матери она была равна 93,8±16,4 и 322,6±21,9 нг/мл. В пересчете на 1 кг массы плодов это составляло 30,6±8,3 и 101,7±20,8 нг/мл при ИНЗД и 28,55±4,79 и 85,45±6,98 нг/мл при ИЗД матери.
При одинаковой тяжести заболевания матери несколько более высокий уровень гормонов гипофизарно-надпочечниковой системы был выявлен у плодов, рожденных через естественные родовые пути. Так, по отношению к принятому за 100% уровню АКТГ у плодов, извлеченных путем планового кесарева сечения, концентрация гормонов у плодов, рожденных через естественные родовые пути, составила при ИЗД 108,5%, а при ИНЗД 144,7%. Соответствующие показатели концентрации кортизола были равны 145,8 и 139,3%. Характерно, что в обеих группах новорожденных уровень исследуемых гормонов оказался ниже, чем в крови их матерей.
Основываясь на данных большинства авторов о более высоком содержании кортизола в крови матери, чем в пуповинной крови плода, а также учитывая указания на возможность трансплацентарного перехода кортизола, ряд авторов высказывали предположение о том, что более высокое содержание кортикостероидов в пуповинной крови новорожденных, возможно, объясняется их переходом от матери к плоду.
Проведя корреляционный анализ, мы, как и Э. Р. Баграмян (1980), не выявили достаточно тесной корреляционной связи между соответствующими показателями матери и плода (R=0,21 в Fф=0,63 для АКТГ, R=0,18 и Fф=0,49 для кортизола). Отсутствие корреляционной зависимости между уровнем кортикостероидов у матери и плода, а также более выраженная, чем у матери, реакция плода на родовой стресс, позволяют нам сделать вывод о высокой функциональной активности надпочечников плода.
Таким образом, в проведенных нами исследованиях установлено наличие тесной взаимосвязи между функциональным состоянием аденогипофиза и коры надпочечников у больных сахарным диабетом. Об этом свидетельствуют синхронные изменения содержания АКТГ и кортизола в крови матери и плода в зависимости от тяжести диабета и метода родоразрешения, при этом более активная реакция как на метаболический, так и на родовой стресс выявлена со стороны надпочечников плода.
Особенности соматотропной функции гипофиза матери и плода при сахарном диабете. Наиболее характерной функциональной особенностью соматотропного гормона гипофиза (СТГ), или гормона роста (ГР), можно считать его влияние на белковый обмен, которое проявляется в активации синтеза белков и торможении их катаболизма. При этом отмечаются увеличение образования аминокислот и включение их в белковые молекулы, что, по мнению М. И. Балаболкина (1978), обусловлено увеличением проницаемости клеточных мембран для аминокислот и одновременным подавлением активности некоторых протеолитических ферментов. Гормон роста усиливает синтез РНК и, кроме того, принимает участив в регуляции углеводного, жирового и минерального обмена. СТГ активирует поступление глюкозы из печени за счет повышения секреции глюкагона, который приводит к усилению гликогенолиза и стимулирует секрецию инсулина, в результате чего- увеличивается утилизация глюкозы тканями.
На клеточном уровне СТГ совместно с глюкокортикоидами выступает как антагонист инсулина и тормозит поглощение глюкозы, активируя В-липопротеиновую фракцию крови, ингибирующую гексокиназную реакцию (пусковую реакцию углеводного обмена); кроме того, СТГ активирует инсулиназу печени. Конечный результат действия СТГ на углеводный обмен зависит от взаимодействия всех трех факторов, поэтому в зависимости от условий СТГ может давать как гипогликемический, так и гипергликемический эффект.
СТГ активирует липолиз жировой ткани, что ведет к повышению уровня свободных жирных кислот (СЖК), накоплению и окислению их в печени. Жиромобилизующее действие СТГ осуществляется посредством активации аденилциклазной системы. Следовательно, при больших энергетических затратах организма, которые не могут быть компенсированы за счет одних углеводов, под влиянием СТГ повышается мобилизация и использование жировых запасов, что предохраняет аминокислоты и белки от распада.
Уровень гормона роста в сыворотке крови изменяется под влиянием центральной нервной системы и секреторной активности других эндокринных желез. Стимуляторами секреции СТГ являются внутриклеточная недостаточность глюкозы (инсулиновая гипогликемия)) L-ДОФА и особенно тиреоидные гормоны, в то время как: норадрейалин и большие дозы глюкокортикоидов оказывают на нее ингибирующее влияние. Анаболический эффект действия СТГ зависит от наличия инсулина (инсулин активирует обмен углеводов и стимулирует синтез белка) и концентрации глюкокортикоидов (небольшие дозы глюкокортикоидов способствуют реализации анаболического эффекта СТГ, а большие угнетают его).
Таким образом, СТГ оказывает сложное и многообразное воздействие на весь метаболизм организма, особенно на те виды обмена веществ, которые при сахарном диабете изменяются в первую очередь. В связи с этим сравнительное изучение содержания СТГ в крови у здоровых и больных сахарным диабетом рожениц и их плодов позволяет расширить наши представления об общих закономерностях регуляции обменных процессов системы мать - плод как в физиологических условиях, так и при сахарном диабете.
В настоящее время сведения о состоянии соматотропной функции гипофиза у здоровых беременных ограничены и противоречивы. Согласно результатам исследований Э. Р. Баграмян (1980), уровень ГР при беременности не отличается от такового у небеременных и существенно не изменяется в течение беременности. В то же время М. И. Балаболкин (1978), О. Н. Савченко и соавт. (1981), Dokumov и соавт. (1975) отмечали снижение соматотропной активности аденогипофиза к концу беременности, a Czech и соавт. (1979) установили, что в последние месяцы беременности уровень СТГ повышается.
Нагрузка глюкозой, как и стимуляция аргинином или инсулиновой гипогликемией, вызывает у беременных очень слабую реакцию аденогипофиза. В связи с этим некоторые авторы считают, что при беременности роль СТГ в регуляции углеводного обмена ограничена.
На основании своих наблюдений М. И. Балаболкин (1978), а также Czech и соавт. (1979) пришли к заключению, что под влиянием родового стресса и высокой активности метаболических процессов концентрация СТГ в крови рожениц повышается. Противоположной точки зрения придерживаются Kuczynski и Michalkiewicz (1973), Dokumov и соавт. (1975), по данным которых уровень СТГ в начале родов заметно снижается. В то же время Э. Р. Баграмян (1980) не выявила у здоровых рожениц ни повышения концентрации ГР, ни ее изменения в зависимости от способа родоразрешепия.
По мнению Э. Р. Баграмян (1980), обнаруженная у беременных слабая реакция аденогипофиза на родовой стресс, а также неадекватное повышение у них уровня СТГ в ответ на действие различных стимуляторов свидетельствуют о подавлении к концу беременности соматотропной активности, что, по-видимому, обусловлено влиянием высокого уровня плацентарного лактогена и прогестерона.
В противоположность этому, секреторная активность аденогипофиза плода в отношении продукции СТГ проявляется в самые ранние сроки его развития. Так, по данным Gitlin и соавт. (1965), начиная с 5-й недели внутриутробного развития ткань фетального гипофиза способна стимулировать СТГ. Этот гормон обнаружен в гипофизах плодов уже при сроке беременности 9 - 12 нед, и по мере развития беременности концентрация его повышается.
Особенно интенсивное увеличение концентрации СТГ у плода -отмечается в первой половине онтогенетического развития. Начиная с 26 - 32-й недели беременности темпы повышения уровня фетального СТГ снижаются, но содержание его в крови плода остается все же выше, чем у матери. По мнению Т. С. Прониной (1974), это обусловлено высоким уровнем обменных процессов в организме плода. Повышенное содержание СТГ, в 5 раз превышающее его уровень в крови матери, обнаружено также в околоплодных водах [Балаболкин М. И., 1978]. Высокий уровень фетального СТГ нельзя объяснить ни снижением его клиренса, ни поступлением гормона от матери к плоду, так как доказано отсутствие перехода СТГ через плацентарный барьер.
Все изложенное выше позволяет сделать вывод о высокой продукции СТГ гипофизом плода. Это подтверждается и результатами наблюдений Furner и соавт. (1973), отметивших у плода выраженную соматотропную реакцию на внутривенное введение матери аргинина, на которое она реагировала слабо. По мнению М. И. Балаболкина (1978), высокая продукция фетального СТГ обусловлена высокими темпами роста плода на протяжении всего периода его внутриутробного развития.
При физиологически протекавших родах Pookai и соавт. (1975), Czech и соавт. (1979) не выявили существенных различий в содержании СТГ в крови матери и плода. Однако, согласно результатам наблюдений ряда авторов [Балаболкин М. И., 1978; Второва В. Г. и др., 1979; Bergman et al., 1978, и др.], концентрация СТГ в пуповинной крови плодов значительно выше, чем в крови их матерей, и заметно меняется в зависимости от метода родоразрешения.
Так, по данным Э. Р. Баграмян (1980), уровень СТГ в пуповинной крови детей, рожденных через естественные родовые пути, был в 2 раза выше, чем у новорожденных, извлеченных во время планового кесарева сечения, при этом концентрация СТГ в крови рожениц оставалась без существенных изменений.
Полученные данные позволили сделать заключение о наличии у доношенных плодов вполне сформировавшейся соматотропной функции гипофиза [Савченко О. Н. и др., 1981] и достаточно зрелой гипоталамо-гипофизарной системы [Баграмян Э. Р., 1980]. Это обеспечивает адекватное становление у здоровых детей процессов адаптации в анте- и постнатальном периоде.
Обоснованность этой точки зрения подтверждается выраженным изменением соматотропной функции гипофиза при различной силе [Старостина Г. А., 1977] и продолжительности [Kuczynski, Miclialwiewicz, 1973] родовой деятельности и развитии таких осложнений, как гипоксия.
Согласую результатам исследований В. Г. Второвой и соавт. (1979), содержание СТТ в периферической крови рожениц, больных диабетом, не отличается от такового у женщин контрольной группы (соответственно 3,52±0,53 и 3,45±1,0 нг/мл). Не было выявлено также различий в показателях соматотропной функции аденогипофиза у больных, родивших маловесных и крупных детей, а также при натальной гипоксии плода.
Опубликованные в литературе данные об особенностях соматотропной функции гипофиза у потомства больных сахарным диабетом женщин весьма противоречивы. Bergman и соавт. (1978) обнаружили высокий уровень гормона роста в пуповинной крови детей при сахарном диабете матери. Согласно данным, полученным Laron и соавт. (1967), Cole и соавт. (1970), базальный уровень СТГ у потомства больных сахарным диабетом матерей практически равен таковому у детей, у матерей которых отмечалось физиологическое окончание беременности. В противоположность этому Westphal (1968) обнаружил, что уровень СТГ у новорожденных от больных сахарным диабетом матерей ниже, чем в контрольной группе. Можно предположить, что такое противоречие при оценке функционального состояния соматотропной функции гипофиза у плодов и новорожденных от матерей, страдающих сахарным диабетом, обусловлено не совсем однородным составом исследуемых групп.
Как показали проведенные нами исследования, содержание СТГ в общей группе больных сахарным диабетом, у которых роды произошли через естественные родовые пути, было слегка снижено - 3,5±0,44 нг/мл (78,6% по отношению к принятому за 100% уровню СТГ у здоровых рожениц). При этом у рожениц с более тяжелым течением заболевания концентрация СТГ равнялась 3,93±0,7 нг/мл (88%), а при НЗД уровень СТГ составлял 3,3±0,6 нг/мл (74%).
Таким образом, существенных различий в показателях соматотропной активности при неосложненных родах у здоровых и больных сахарным диабетом рожениц установлено не было. Также не обнаружено заметных изменений соматотропной активности аденогипофиза у рожениц с различной тяжестью диабета.
Согласно данным Г. Г. Алексеевой и соавт. (1980), повышение концентрации СТГ у больных сахарным диабетом наблюдается в период декомпенсации, что в условиях выраженной инсулиновой недостаточности имеет компенсаторный характер и способствует предотвращению возникновения энергетического дефицита. В то же время при стабильном течении неосложненного диабета или после достижения компенсации заболевания исходный уровень СТГ существенно не отличается от такового в контрольной группе [Славнов В. Н. и др., 1977].
Поскольку в настоящей главе излагаются особенности гормонального статуса матерей, больных сахарным диабетом, и Их плодов при неосложненном течении родового акта и при отсутствии oосложнений диабета и беременности, то приведенные нами данные вполне объяснимы. Действительно, влияние родового акта на соматотропную активность гипофиза проявилось в небольшом повышении уровня СТГ у рожениц, у которых роды произошли через естественные родовые пути: 3,93±0,7 нг/мл при самопроизвольных родах и 2,91±0,4 нг/мл при абдоминальном родоразрешении.
Эти результаты не совпадают с данными исследований здоровых рожениц, приведенными в работах Э. Р. Баграмян (1980) и др. В связи с этим можно предположить, что, несмотря на торможение секреторной функции аденогипофиза у беременных при сахарном диабете влияние родового стресса является достаточно активным раздражителем, что вызывает необходимость значительного напряжения у них компенсаторных механизмов и приводит к повышенному выбросу СТГ.
Для более детальной оценки состояния соматотропной функции гипофиза плодов при сахарном диабете матери мы исследовали содержание гормона роста в пуповинной крови в зависимости от тяжести диабета матери, способа родоразрешения, наличия диабетических осложнений, а также от состояния ребенка в момент рождения.
Проведенные исследования показали, что у плодов от больных сахарным диабетом, так же как и от здоровых женщин, активность соматотропной функции гипофиза достоверно превышает таковую у их матерей. Так, уровень СТГ в пуповинной крови новорожденных от матерей с сахарным диабетом был равен 10,53±0,4 нг/мл, в контрольной группе - 9,64±1,4 нг/мл. В венозной крови содержание СТГ составляло соответственно 3,5±0,44 и 4,45±1,1 нг/мл (P<0,001 и <0,01). Таким образом, уровень СТГ в пуповинной крови плодов в основной и контрольной группах превышал таковой в крови их матерей в 3 и 2,2 раза.
Исследуя зависимость соматотропной функции аденогипофиза плодов от тяжести заболевания матери, мы выявили, что у плодов от матерей с тяжелыми, инсулинзависимыми формами диабета содержание СТГ было ниже (9,53±1,3 нг/мл), чем в аналогичной группе плодов, матери которых не нуждались в применении инсулинотерапии (12,93±2,0 нг/мл) (P<0,05), и практически не отличалось от такового в контрольной группе (9,64±1,4 нг/мл). При пересчете содержания гормона на 1 кг массы тела ребенка выявленная зависимость проявилась еще более ярко (соответственно 2,68±0,3 и 4,47±0,73 нг/мл).
Аналогичные результаты получены Л. М. Кондратович и соавт. (1982), которые провели сравнительный анализ двух групп новорожденных с высоким и низким уровнем СТГ при рождении. При этом у матерей детей, родившихся с низким содержанием гормона роста в пуповинной крови, выявлены тяжелые формы диабета, осложненного диабетической микроангиопатией с частыми декомпенсациями. У новорожденных этой группы отмечены высокий уровень гликемии и инсулинемии, осложненное течение периода новорожденности, значительное уменьшение массы тела и замедленное ее восстановление. В то же время у новорожденных с высоким содержанием СТГ при рождении уровень гликемии и инсулинемии был умеренным, а течение периода новорожденности - более благоприятным. У всех матерей этих детей выявлены легкие формы диабета.
Таким образом, на основании полученных данных можно сделать заключение, что тяжесть диабета матери оказывает выраженное влияние на функциональное состояние аденогипофиза плода. Степень выраженности этого влияния, по-видимому, зависит от двух факторов: 1) необходимости в компенсаторной активации контринсулярных систем плода и 2) функционального состояния и секреторной активности этих систем.
В то же время у новорожденных от матерей с одинаковой тяжестью заболевания (ИЗД) изменений уровня СТГ при различных способах родоразрешения практически не было: 9,58±1,3 нг/мл при родах через естественные родовые пути и 10,06±1,4 нг/мл при абдоминальном родоразрешения. При пересчете на 1 кг массы тела новорожденных эти показатели составляли соответственно 26,8±0,3 и 2,8±0,4 нг/мл.
Таким образом, проведенное нами исследование состояния соматотропной функции гипофиза у матерей, больных сахарным диабетом, и их плодов позволило установить наличие у них, как и у здоровых плодов, более высокого, чем у матерей, уровня СТГ.
Родовой акт способствует увеличению содержания СТГ в крови здоровых и больных сахарным диабетом рожениц, а также здоровых новорожденных и не оказывает существенного влияния на содержание гормона у плодов. Различная тяжесть заболевания оказывает противоположное влияние на соматотропную активность гипофиза матерей, больных сахарным диабетом, и их плодов. В то время как у больных ИНЗД рожениц содержание СТГ было ниже, чем у рожениц с ИЗД, в пуповинной крови их плодов уровень гормона роста оказывался более высоким, что, по нашему мнению, является проявлением повышения секреторной активности фетальной гипофизарно-надпочечниковой системы в ответ на относительную гипогликемию, развившуюся у плодов под влиянием индуцированного гиперинсулинизма.
Особенности функционального состояния симпатико-адреналовой системы у больных сахарным диабетом матерей и их плодов. Среди систем, осуществляющих защитно-приспособительные реакции организма, особое место занимает симпатико-адреналовая система (САС), которая обеспечивает корреляцию между всеми функциональными системами организма, участвуя одновременно и в нервных, и в гормональных механизмах интеграции обменных процессов. Этот эффект обусловлен наличием у катехоламинов (КА) дополнительной структурной единицы - пирокатехинового ядра, вследствие чего КА в отличие от других высокоактивных биогенных аминов обладают возможностью срочно переключаться с одного вида обмена на другой. Это создает особую лабильность САС и приводит к быстрому развитию адаптационных реакций [Утевский А. М., Осинская В. О., 1977].
По механизму своего действия КА являются экстрацеллюлярными регуляторами, влияние которых осуществляется путем их взаимодействия с "двумя посредниками" гормонального эффекта - циклическими мононуклеотидами, представляющими собой как бы функциональные мостики между рецепторами клеточной мембраны, и внутриклеточными ферментами.
Действие адреналина (А) на обмен веществ опосредовано через аденилциклазу, катализирующую образование циклического 3,5- аденозинмонофосфата (цАМФ), который в свою очередь активирует выработку ключевых ферментов углеводного и жирового обмена - фосфорилазу и липазу. Возрастающая под влиянием КА активность фосфорилазы приводит к усилению мобилизации гликогена печени, при этом снижается способность тканей ассимилировать глюкозу, в результате чего развивается гипергликемия и глюкозурия.
Действие КА на жировой обмен также обусловлено их взаимосвязью с цАМФ, который стимулирует превращение неактивной липазы в активную, что способствует ускорению липолиза, увеличению содержания СЖК в тканях и крови. Обусловленное влиянием КА интенсивное усиление липолитических процессов обеспечивает более полное удовлетворение энергетических потребностей организма, что особенно важно в условиях нарушения утилизации глюкозы, присущей сахарному диабету. У больных сахарным диабетом при декомпенсации заболевания или в ответ на развитие инсулиновой гипогликемии наблюдается компенсаторное повышение активности CAС.
Большой интерес представляет вопрос о функциональном состоянии САС при нормальной и патологически протекающей беременности. Согласно результатам исследований М. М. Шехтмана и соавт. (1976), Logaras и соавт. (1975), в функциональном состоянии САС во время и вне беременности существенных изменений не происходит. В то же время, по данным Bourdon и соавт. (1978), по мере увеличения срока беременности экскреция с мочой А и норадреналина (НА) прогрессивно возрастает. И. П. Грыжак и Л. В. Тимошенко (1980) пришли к заключению, что пик экскреции А наблюдается в начале беременности, выделение НА и дофамина (ДА) в течение беременности существенно не изменяется, а экскреция диоксифенилаланина (ДОФА) увеличивается.
По мнению Л. В. Тимошенко и соавт. (1977), для нормально протекающей беременности особое значение приобретает активация адреналового звена САС, поддерживающего функциональную" активность тех систем организма, которые в данный момент имеют наибольшее значение. В то же время, согласно наблюдениям Parvez и Grippes (1974), при беременности отмечается повышение относительной активности медиаторного звена CAС в связи с торможением метилирования НА в А, что вызвано пермиссивным действием глюкокортикоидов.
По данным Л. В. Тимошенко и соавт. (1981), при переношенной беременности и антенатальной гибели плода экскреция КА снижается, а при поздних токсикозах - возрастает. В то же время, согласно наблюдениям Л. Н. Сотниковой (1969) и Л. П. Гороховского (1974), присоединение поздних токсикозов приводит к угнетению функции САС. По-видимому, противоречивость этих данных обусловлена неоднородным составом исследуемых групп.
Высокое содержание КА, особенно ДА, обнаружено и в околоплодных водах [Bourdon et al., 1976; Philippe et al., 1981; Artal et al., 1982]. Особенно значительно концентрация ДА повышается во время родов, что явилось основанием для предположения о его участии в родовом акте.
Исследуя функциональное состояние САС у здоровых рожениц, многие авторы отмечали повышение уровня КА во время родов. При этом, согласно наблюдениям О. Н. Аржановой (1976), экскреция А по сравнению с таковой во время беременности несколько снижается, а выделение с мочой НА увеличивается. Соответственно изменяется и коэффициент А/НА, что, по мнению Я. Д. Селепей (1975), свидетельствует о преобладании во время родов через естественные родовые пути относительной активности медиаторного звена САС.
Развитие слабости родовой деятельности приводит к уменьшению содержания КА [Старостина Т. А., 1977]. При абдоминальном родоразрешении, согласно результатам исследований Halter и Pflug (1980), в крови заметно повышается уровень А, что авторы в основном связывают с действием ингаляционного наркоза.
Таким образом, согласно данным литературы, активность симпатико-адреналовой системы в родах резко возрастает. В связи с этим высказано предположение, что КА вызывает и стимулирует родовую деятельность.
Значительный интерес вызывает изучение уровня КА у потомства здоровых матерей. Установлено, что под влиянием родового стресса уровень КА у плодов заметно превышает таковой у рожениц [Быкова Г. Ф., 1974]. Развитие гипоксии приводит к резкому повышению концентрации КА в пуповинной крови плода [Быкова Г. Ф., 1974; Lagerkrantz, Bistoletti, 1977]. По данным Divers (1981), задержка внутриутробного развития плода сопровождается значительным повышением адренергической и снижением дофаминергической активности. При этом, согласно наблюдениям Kaneoka и соавт. (1979), Artal и соавт. (1982), у детей, у которых при рождении отмечались особенно высокие концентрации КА, до и во время родов было зарегистрировано ухудшение их функционального состояния, а период новорожденности протекал с осложнениями.
Высокую активность САС Nakai и Jameda (1978) связывают с наличием дистресс-синдрома плода и считают, что высокое содержание КА в пуповинной крови позволяет прогнозировать развитие осложнений у плода. По данным других авторов, адреналин, взаимодействуя с аденилциклазой, реализует сурфактант из альвеолярных клеток, и в связи с этим отмечено наличие корреляции между уровнем КА в околоплодных водах и зрелостью легких плода.
Данные об особенностях функционального состояния САС у беременных, больных сахарным диабетом, их плодов и новорожденных немногочисленны и противоречивы. Согласно наблюдениям Lagerkrantz (1980), существенного различия в экскреции К А у здоровых и больных сахарным диабетом беременных не наблюдается.
По мнению Joung и соавт. (1979), для потомства женщин, больных сахарным диабетом, наиболее характерно повышенное содержание НА в крови, которое коррелирует с тяжестью диабета матери и не зависит от гестационного возраста плода. В то же время, изучая функциональное состояние САС у плодов и новорожденных, матери которых больны сахарным диабетом, Artal и соавт. (1982) выявили, что уровень КА в околоплодных водах у этих детей тесно коррелировал со степенью зрелости легочной ткани плода.
В исследованиях этих же авторов установлено, что, несмотря на встречающуюся у потомства матерей, больных сахарным диабетом, различную активность САС, у большинства новорожденных содержание всех фракций КА в пуповинной крови было значительно повышено и коррелировало с их массой тела и тяжестью диабета матери. Можно предполагать, что увеличение функциональной активности САС в период внутриутробного развития может способствовать в дальнейшем истощению резервных возможностей этой системы у потомства больных матерей.
Противоположной точки зрения по вопросу о состоянии САС у плодов и новорожденных от больных сахарным диабетом матерей придерживается Amendt (1978), отметивший у плодов повышение концентрации адреналина, а у новорожденных снижение экскреции КА. Stern и соавт. (1980) также не обнаружили у новорожденных от больных сахарным диабетом матерей повышения секреторной активности САС в ответ на свойственную этим детям после рождения гипогликемию.
При проведенном нами сравнительном анализе показателей функционального состояния САС у здоровых и больных сахарным диабетом беременных у последних установлена более высокая экскреция КА с мочой. Так, если уровень экскреции А, НА и ДА у здоровых беременных принять за 100%, то в общей группе беременных, больных сахарным диабетом, составленной без учета тяжести заболевания, он составлял соответственно 177% (5,9±0,6 мкг/сут, P<0,02), 161% (8,34±1,65 мкг/сут, P>0.05) и 158% (223,7±122,2 мкг/сут, P<0,02).
На фоне заметного повышения экскреции биологически активных КА особое внимание обращает на себя достоверное снижение экскреции их предшественника ДОФА (80,75±9,19 мкг/сут при сахарном диабете и 126,36±24 мкг/сут у здоровых беременных), это свидетельствует о значительной напряженности у беременных, больных сахарным диабетом, процессов биосинтеза КА.
Влияние тяжести заболевания на функциональное состояние САС у обследованных беременных проявлялось в достоверном повышении экскреции А при более тяжелом течении диабета (7,64±0,96 мкг/сут при ИЗД и 3,78±0,4 мкг/сут при ИНЗД, что составляет соответственно 229 и 113,5% по сравнению со 100% в контроле), несколько более высоком, чем при легких формах заболевания, уровне экскреции ДА (соответственно 253,6±25,9 и 201,6±27,04 мкг/сут) и практически одинаковых уровнях экскреции НА (8,24±2,35 мкг/сут).
В то же время при определении относительной активности отдельных этапов биосинтеза КА, проведенном с помощью вычисления отношения каждого из изучаемых веществ к его предшественнику в цепи биосинтеза КА (А/НА НА/ДА, ДА/ДОФА), установлено, что как у здоровых, так и у больных сахарным диабетом беременных наблюдается некоторое преобладание симпатических влияний, о чем свидетельствует уменьшение коэффициента А/НА ниже единицы (0,6 в контроле, 0,71 в общей группе беременных, больных сахарным диабетом). В то же время у беременных с тяжелым ИЗД на фоне нарушения практически всех этапов биосинтеза КА наблюдалось более выраженное, чем при легком диабете, повышение относительной активности адренергического звена САС. Так, если величину всех коэффициентов относительной активности отдельных звеньев САС у здоровых беременных принять за 100%, то при ИЗД они составят: А/НА 155%, НА/ДА 88,9%, ДА/ДОФА 271%. При ИНЗД эти показатели соответственно равны 75; 117 и 231% (рис. 2).
Необходимость в компенсаторном повышении относительной активности адренергического звена САС при более тяжелых формах сахарного диабета можно связать с эндогенным стрессом (стрессорным фактором является дефицит энергии, вызванный выраженной инсулиновой недостаточностью), так как А активно способствует ускорению липолиза и повышению уровня СЖК в крови. При этом одновременное уменьшение у беременных, больных ИЗД, коэффициента НА/ДА и повышение отношения ДА/ДОФА позволяют прийти к выводу о нарушении у них трансформации ДА в НА. Поскольку экскреция ДА у беременных этой группы несколько повышена, в то время как экскреция НА при различной тяжести диабета оставалась стабильной, можно предположить, что в основе выявленного нарушения лежит ферментативная недостаточность, в частности недостаточная активность дофамин-β-гидроксилазы.
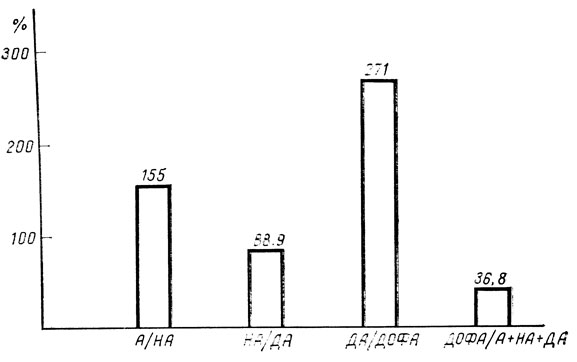
Рис. 2. Показатели относительной активности симпатико-адреналовой системы у беременных, больных ИЗД
Для оценки функционального состояния и резервных возможностей САС в различных группах беременных большой интерес представляет сравнительный анализ величины отношения ДОФА (предшественник КА) к сумме биологически активных КА (А+НА+ДА), который дает возможность оценить интенсивность общих процессов биосинтеза КА. Проведенное нами в контрольной и исследуемой группах вычисление этого коэффициента позволило установить заметное его снижение при сахарном диабете (100% в контрольной группе и 40,8% в общей группе беременных, больных сахарным диабетом), которое увеличивается при более тяжелой форме заболевания (42,8% при легком и 36,8% при тяжелом и среднетяжелом течении диабета). Полученные данные подтверждают высказанное нами предположение о том, что компенсаторное повышение активности САС, необходимость в котором часто возникает при сахарном диабете, в конечном итоге приводит к снижению резервных возможностей этой системы.
Достоинством метода определения экскреции КА с мочой является возможность получить представление о функциональном состоянии САС за сравнительно длительный отрезок времени (не менее суток), в то время как вследствие особой лабильности САС, быстро отвечающей на многочисленные эндо- и экзогенные раздражители, при определении уровня КА в крови возможно оценить функцию адренергического и медиаторного звеньев САС только в момент исследования. В связи с этим содержание КА в крови нельзя рассматривать как адекватный показатель функционального состояния САС на протяжении всего родового акта.
Мы использовали метод радиоиммунологического определения КА в крови, для того чтобы получить сопоставимые данные о концентрации КА у матери и плода. При этом мы исходили из предположения, что в момент рождения плода его САС подвержена влиянию преимущественно более стабильных эндогенных раздражителей.
В результате проведенных исследований было установлено, что в крови беременных, больных ИЗД, содержание адреналина практически не отличалось от такового в контроле (соответственно 2,39±0,57 И 2,14±0,59 мгк/л) И было умеренно повышено у беременных, находящихся только на диетотерапии (3,66±0,92 мкг/мл). Соответствующие показатели для норадреналина составляли 2,15±0,79 и 1,8±0,48 мкг/л.
Если исходить из данных Г. Г. Алексеевой и соавт. (1980), С. В. Уголевой и соавт. (1982) о высоком содержании КА в крови больных сахарным диабетом в период декомпенсации и приближении его к норме после достижения компенсации заболевания, то полученные нами данные следует рассматривать как результат достаточной компенсации сахарного диабета и сравнительно стабильного течения беременности. При этом, исходя из наших наблюдений, состояние метаболического стресса более отчетливо проявлялось у беременных, не получавших инсулин.
Было выявлено, что под влиянием родового акта активность адреналового звена САС у больных контрольной группы повышается по сравнению с беременными почти в 2 раза, а медиаторного - в 11/2 раза (4,15±0,76 и 3,38±0,64 мкг/л). В то же время при сахарном диабете были отмечены очень небольшие изменения в показателях А и НА. Так, в конце второго периода родов у больных ИЗД содержание А и НА в крови составило 2,4±0,5 и 1,76±0,3 мкг/л, у больных ИНЗД - 2,14±0,57 и 2,06±0,6 мкг/л. Эти показатели не имели статистических различий (P>0,05).
Степень тяжести сахарного диабета не оказывала заметного влияния на содержание А во время родов (57,8% при ИЗД, 51,56% при ИНЗД и 100% у здоровых рожениц), в то время как содержание НА у больных ИНЗД по сравнению с более тяжелобольными было слегка повышено (52% при ИЗД, 60,94% при ИНЗД и 100% в контроле).
Учитывая, что организм рожениц, больных сахарным диабетом, находится под двойным стрессорным влиянием (эндогенный метаболический и родовой стресс), выявленную нами слабую реакцию на роды и более низкий, чем в контроле, уровень КА следует расценивать как проявление прогностически неблагоприятной неполноценности адаптационной системы больных сахарным диабетом и ее быстрого истощения. Это в свою очередь может привести: к развитию в родах не только метаболических, но и акушерских осложнений. Как уже было отмечено ранее, наиболее часто во время родов у больных сахарным диабетом возникали такие осложнения, как прогрессирующая гипоксия плода и выраженная (особенно во второй период родов) слабость родовой деятельности.
Таким образом, наши наблюдения согласуются с результатами исследований Т. А. Старостиной (1977), которая у рожениц со слабостью родовой деятельности выявила отчетливое снижение содержания КА в крови. При одинаковой тяжести заболевания у больных ИЗД, у которых роды произошли через естественные родовые пути, уровень А в крови был несколько ниже (2,4±0,69 мкг/л), а НА - выше (1,76±0,3 мкг/л), чем при кесаревом сечении (соответственно 4,37±1,35 и 0,94±0,26 мкг/л). Аналогичные результаты были получены Я. Д. Селепей (1975) и О. Н. Аржановой (1978) при обследовании здоровых рожениц, согласно наблюдениям которых в родах отмечается преобладание активности медиаторного звена САС. В то же время, согласно исследованиям Halter и Pflug (1980), при абдоминальном родоразрешении в связи с действием ингаляционного наркоза заметно повышается уровень в крови адреналина.
Таким образом, влияние родового акта на активность адренергического и медиаторного звеньев САС отличается от такового у здоровых беременных только в количественном отношении.
При сравнительном анализе содержания КА в крови у здоровых и больных сахарным диабетом матерей с этими показателями у их плодов у последних было выявлено достоверное повышение уровня КА: в контрольной группе 159% (А) и 136,7% (НА), а при сахарном диабете соответственно 229 и 194,7% по отношению к принятым за 100% показателям матери. Однако по сравнению с принятым за 100% содержанием КА в пуповинной крови здоровых плодов уровень А и НА в исследуемой группе был несколько ниже и составлял соответственно 5,21±0,84 (78,58%) и 3,7±0,78 (80%) мкг/л.
Исследуя изменения активности КА в крови плодов в зависимости от тяжести сахарного диабета матери и способа родоразрешения, мы установили, что при тяжелом течении заболевания (ИЗД) уровень А в пуповинной крови плодов существенно не отличался от такового в контроле (соответственно 96,4 и 100%), в то время как у плодов от матерей с ИНЗД он был существенно ниже (61%; P<0,1). При пересчете на 1 кг массы тела плода это составляло 2,27±0,58 мкг/л в контроле, 2,22±0,52 мкг/л при ИЗД и 1,23±0,21 мкг/л при ИНЗД матери.
В то же время влияние тяжести заболевания матери на активность медиаторного звена САС у плода проявилось в незначительном повышении уровня НА (86,79% при ИЗД, 73,3% при ИНЗД и 100% в контроле). В пересчете на 1 кг массы тела плода это составило соответственно 1,22±0,45; 0,84±0,18 и 1,62±0,36 мкг/л. При этом у плодов от матерей с одинаковой тяжестью диабета, роды у которых происходили через естественные родовые пути, уровень А был несколько ниже (6,39±1,55 мкг/л), а НА - выше (4,01±1,29 мкг/л), чем при абдоминальном родоразрешении (соответственно 9,32±2,98 и 3,15±0,93 мкг/л). В пересчете на 1 кг массы тела это составило 2,22±0,52 и 3±0,84 мкг/л для А, 1,22±0,45 и 0,87±0,21 мкг/л для НА.
Таким образом, установлена одинаковая направленность динамики КА у матери и плода, что свидетельствует о тесной взаимосвязи между функциональным состоянием их САС. Эта точка зрения подтверждена результатами проведенного нами корреляционного анализа, который позволил убедиться в наличии четкой корреляционной связи между содержанием КА в крови матери и плода. Особенно выражена эта зависимость у больных с более тяжелыми формами диабета.
Содержание цАМФ в крови больных сахарным диабетом матерей и их плодов. В отличие от стероидных гормонов, проникающих в цитоплазму, а затем и в ядро клетки, действие гормонов нестероидной природы, к которым относятся инсулин и большинство контринсулярных гормонов, осуществляется через аденилциклазную систему. Так, инсулин, глюкагон, СТГ, АКТГ, адреналин и другие гормоны, фиксируясь на специфических для каждого гормона рецепторах мембраны, вызывают повышение активности мембранного фермента - аденилциклазы, в результате чего в цитоплазме клеток происходит превращение АТФ в цАМФ. В присутствии цАМФ происходит активация особого фермента - цАМФ-зависимой протеинкиназы, которая переносит фосфорный остаток с АТФ на ферментные белки (протеинкиназы), превращая таким образом неактивную форму протеинкиназы в активную. В результате этого свойства различных протеинкиназ изменяются в том направлении, которое характерно для действия гормона. Таким образом, внутри клеток действует не сам гормон, а его "посредник" - цАМФ.
Являясь передатчиком в реализации гормонального воздействия, цАМФ способствует подавлению гликогеногенеза, активации гликогенолиза и липолиза, стимуляции в присутствии глюкозы биосинтеза и секреции инсулина, обусловливает эффект глюкагона, α- и β-рецепторов на секрецию инсулина, стимулирует освобождение гипофизарных гормонов, которые в свою очередь направляют синтез и освобождение кортикостероидов, половых и тиреоидных гормонов. Кроме того, цАМФ влияет на мембранную проницаемость, синтез белков, служит медиатором действия норадреналина, может проникать в ядро клеток и стимулировать продукцию РНК, которые обеспечивают синтез различных гормонов.
Различный выход глюкозы из печени под действием инсулина и глюкагона объясняется их противоположным влиянием на уровень цАМФ в клетках. Подавление под влиянием инсулина базального и стимулированного липолиза сопровождается уменьшением содержания цАМФ в клетках, в то время как липолитическиа гормоны (АКТГ, ТТГ, глюкагон адреналин) способствуют повышению уровня цАМФ. В связи с этим уровень цАМФ характеризует скорость процессов липолиза в организме.
По данным В. И. Мосина и соавт. (1980), содержание цАМФ у больных сахарным диабетом увеличено, причем уровень цАМф но коррелирует с тяжестью заболевания, но зависит от степени компенсации диабета. Наличие связи между уровнем инсулина и концентрацией цАМФ установили Ю. А. Князев и соавт. (1980), прет этом введение экспериментальным животным с легким диабетом экзогенного цАМФ вызывало, хотя и замедленное, но более выраженное, чем у здоровых животных, повышение уровня инсулина. В то же время при тяжелом течении диабета реакция со стороны инсулярной системы на введение цАМФ отсутствует, что свидетельствует о повреждении β-клеток. В свою очередь содержание цАМФ увеличивается при высоком содержании адреналина, глюкагона, АКТГ и уменьшается под действием инсулина и α-адренергетиков.
По данным Göser и соавт. (1980), Bistoletti и соавт. (1983), наивысший подъем уровня цАМФ наблюдается на 9 - 12-й и 33 - 36-й неделе беременности, при доношенной беременности содержание цАМФ почти в 2 раза выше, чем вне беременности, а при переношенной начинает снижаться. Согласно наблюдениям этих авторов, при неосложненных родах через естественные родовые пути содержание цАМФ выше, чем при абдоминальном родоразрешении и при родовозбуждении простагландинами. В то же время Lahav и соавт. (1980) существенной зависимости концентрации цАМФ от метода родоразрешения не выявили.
В крови плода отмечены более высокий уровень цАМФ и более активная, чем у матери, его реакция на развитие родовой деятельности [Jen et al., 1977]. На этом основании было высказано предположение о том, что во время беременности и в родах синтез цАМФ осуществляется в плаценте и в организме плода. Это предположение подтвердили Bistoletti и соавт. (1983), которые установили, что при появлении осложнений в родах под влиянием адреналина в богатой гликогеном плаценте активируется синтез цАМФ, что приводит к усилению в ней процессов гликогенолиза ж к увеличению энергетических резервов плода.
Согласно данным Fredholm и соавт. (1978), у больных сахарным диабетом базальный уровень цАМФ в конце беременности не отличается от такового у здоровых беременных, но реакция цАМФ на действие липолитических гормонов при сахарном диабете выражена более резко.
Проведенные нами исследования показали, что содержание цАМФ в крови рожениц, больных сахарным диабетом, было несколько ниже, чем у их плодов (соответственно 22,36±4,31 и 29,65±8,84 нг/мл). Тяжесть сахарного диабета не оказывала существенного влияния на уровень цАМФ в крови рожениц (21,42±6,23 нг/мл при ИЗД и 22,88±8,75 нг/мл при ИНЗД). В то же время у плодов от матерей с ИЗД более отчетливо прослеживается тенденция к снижению уровня цАМФ (27,22±8,84 нг/мл при ИЗД и 32,7±10,04 нг/мл при ИНЗД).
Для того чтобы выяснить влияние, которое оказывает гормональный статус рожениц и их плодов на показатели цАМФ, были определены отношения группы гормонов, стимулирующих синтез цАМФ (адреналин+глюкагон+АКТГ), к ингибитору синтеза цАМФ - инсулину. Эти отношения у рожениц составляли 11,49 при ИЗД и 16,0 при ИНЗД. Соответствующие показатели у их плодов были равны 5,64 и 8,98.
Таким образом, гормональные влияния, стимулирующие синтез цАМФ, преобладают при более легких формах заболевания, что, по-видимому, обусловливает у этих больных несколько большую скорость метаболических процессов.
Особенности липидного обмена. Состояние липидного обмена у больных сахарным диабетом тесно связано с гормонами поджелудочной железы и контринсулярными липолитическими гормонами гипофиза и надпочечников. От взаимоотношения между этими системами зависит равновесие многих биологических процессов, происходящих в живом организме.
Основным гормоном, оказывающим анаболическое действие на жировой обмен, является инсулин. Стимулируя поглощение жировой тканью глюкозы, инсулин тем самым способствует синтезу из продуктов углеводного обмена СЖК и триглицеридов (ТГ). Кроме того, он тормозит мобилизацию жира из жировых депо и обусловливает его отложение в подкожной жировой клетчатке. Синергичное с инсулином действие на метаболизм липидов оказывают и глюкокортикоиды, которые усиливают глюконеогенез из углеводов, способствуют образованию жира из белка, тормозят жиромобилизирующее действие липолитических гормонов.
В основе липолитического действия глюкагона, АКТГ и адреналина лежит их свойство посредством активации аденилциклазной системы и протеинкиназ способствовать переходу 3-протеинкиназы в активную форму. Кроме того, адреналин и глюкагон ингибируют синтез жирных кислот в печени, в то время как инсулин активирует его и подавляет протеинкиназу. Таким образом, баланс жирных кислот зависит от преобладающего влияния тех или иных гормонов на соответствующие ферменты.
Синтез и последующая мобилизация из депо жирных кислот играет большую роль в энергообеспечении организма, особенно в условиях нарушения утилизации глюкозы. В процессе окисления одной молекулы жирной кислоты образуется 130 молекул АТФ. Кроме того, вследствие быстрого метаболизма СЖК (период их полураспада равен 3 мин) мобилизация их энергетических резервов может произойти очень быстро. Однако выраженное и продолжительное увеличение в крови содержания СЖК способствует развитию гиперфункции и последующему истощению β-клеток поджелудочной железы.
Физиологически протекающей беременности свойственна выраженная гиперлипидемия, при этом имеется прямая корреляционная зависимость между содержанием липидов в крови и сроком беременности. По данным Skypten и соавт. (1980), максимальный рост липидных фракций отмечен во второй половине беременности, особенно в III триместре. К этому времени содержание общих липидов в крови беременных составляет свыше 1,0 г/л [Renkonnen О., 1966], что значительно превышает этот показатель вне беременности.
Согласно исследованиям Renkonnen (1966), к моменту родов содержание фосфолипидов достигает 96,9 ммоль/л, уровень свободного холестерина составляет 1,8 - 2,2 ммоль/л, эстерифицированного - 4,7 - 4,9 ммоль/л, общего холестерина - 6,9 ммоль/л. Таким образом, содержание фосфолипидов и холестерина у беременных по отношению к уровню соответствующих фракций у небеременных, принятому за 100%, равен 140 и 150, в то время как уровень триглицеридов повышается до 200%. Содержание СЖК начинает увеличиваться с 8-й недели беременности, а максимальное его увеличение отмечено в III триместре [Fairweather, 1965].
Причины повышения уровня СЖК во время беременности изучены недостаточно. Оно может быть обусловлено как нарушением толерантности организма беременных к глюкозе, так и снижением чувствительности к инсулину.
Наиболее выраженное изменение при беременности претерпевают ТГ, уровень которых увеличивается по сравнению с исходным в 2 - 3 раза [Enger, Gustafson, 1973]. Такое повышение в основном является результатом превращения в ТГ большей части усвоенной с пищей глюкозы. Это служит проявлением реакции адаптации беременных, направленной на восстановление энергетических резервов, необходимых для роста и развития плода.
Особенно велико значение липидов во время родов, когда повышенная мышечная и эмоциональная нагрузка роженицы приводит к большим затратам энергии. Другие источники, в частности углеводы, не могут полностью удовлетворить энергетические потребности роженицы. Этот недостаток восполняют липиды, в первую очередь СЖК.
Повышение в родах уровня СЖК (до 200 - 300% по сравнению с таковым вне беременности) обычно совпадает с началом родовой деятельности, что свидетельствует об активации липолитических процессов в условиях недостатка энергетических ресурсов. Наряду с повышением уровня СЖК у рожениц увеличивается содержание в крови ТГ. Увеличение уровня СЖК и ТГ необходимо для возмещения энергетических затрат в родах, в то время как повышение уровня холестерина и фосфолипидов обусловлено увеличением потребности в стероидных гормонах.
Липидный обмен играет большую роль в метаболической адаптации плода, в частности в поддержании его энергетического гомеостаза. Основываясь на результатах многих исследований, Renkonnen (1966) считает, что в крови плода концентрация общих липидов составляет около 300 мг%, при этом количество фосфолипидов достигает 1,1 г/л, общее количество холестерина составляет 1,8 ммоль/л, в том числе свободного 0,6 ммоль/л, эфиров холестерина 1,2 ммоль/л.
Качественный состав липидных фракций в сыворотке плода не отличается от такового у матери, но содержание общих липидов и их отдельных фракций у плода ниже. Исследуя липиды крови здоровых плодов, Ю. В. Тарадайко и В. А. Елымов (1970) установили, что содержание общих липидов в вене пуповины в 21/2 раза ниже, чем в крови матери. Содержание липидов в артерии пуповины значительно ниже, чем в вене, что можно объяснить повышенной утилизацией липидов плодом.
Содержание ТГ у плода резко снижено не только по сравнению с тиковым у матери, по с уровнем других фракций липидов пуповинной крови. Содержание холестерина в вене пуповины достоверно выше, чем в артерии, и коррелирует с уровнем холестерина у матери. Выявлена зависимость между содержанием холестерина у матери, массой плода и плаценты. Полученные данные свидетельствуют о том, что плод обладает способностью депонировать поступающий к нему холестерин матери, что и обусловливает увеличение массы плода и плаценты.
В то же время в исследованиях Blum и соавт. (1980) выявлена зависимость липидограммы плода от наличия стрессовых ситуаций в родах (преждевременные или запоздалые роды и т. д.). В то время как содержание холестерина остается без изменений, уровень ТГ при стрессе значительно повышается. Высказано предположение, что увеличению содержания ТГ при стрессе способствует повышенный трансплацентарный переход СЖК от матери и активизация симпатико-адреналовой системы.
Ведущую роль в межуточном обмене н поддержании энергетического гомеостаза плода играют СЖК, уровень которых у плода значительно ниже, чем у матери. По вопросу о влиянии СЖК матери на их уровень у плода в литературе до настоящего времени существуют противоречивые сведения. В исследованиях Kokot и соавт. (1974) не было установлено корреляционной связи между уровнями СЖК матери и плода. В то же время Whaley и соавт. (1966) пришли к заключению, что повышенное содержание СЖК у матери приводит к увеличению концентрации липидов у плода. Авторы полагали, что в связи с увеличением уровня СЖК у матери возрастает их трансплацентарный переход к плоду, что и обусловливает у него повышенный синтез липидов. Механизм прохождения липидов через плаценту выяснен недостаточно. Полагают, что через плаценту молекулы липидов могут проникать не расщепляясь или после предварительного распада. Плацента, обладая высокой энзиматической способностью, способствует расщеплению таких фракций липидов, как триглицериды и фосфолипиды. Однако, по мнению Szabo и Szabo (1974), транспланцентарный переход липидов матери ограничен, поэтому к плоду поступают избирательно очень небольшие количества СЖК и для большей части липидов плацентарный барьер непроходим. Не исключена также возможность комбинированного образования фетальных липидов.
По мнению большинства авторов, в накоплении плодом богатых энергией веществ главное значение имеет самостоятельный синтез липидов, который и определяет их уровень в крови. Согласно исследованиям Hirsh и соавт. (1960), основная часть липидов плода синтезируется из глюкозы и ее метаболитов. Помимо этого, не исключена возможность синтеза липидов из ацетатов - простейших молекул, проходящих через плацентарный барьер и поступающих от матери к плоду. Таким образом, данные литературы, касающиеся метаболизма липидов у плода, противоречивы.
Известно, что при развитии сахарного диабета нарушения обмена липидов предшествуют изменениям обмена углеводов. В связи с этим исследование липидного обмена у больных сахарным диабетом матерей и их плодов имеет большое значение.
Характерные для сахарного диабета нарушения обмена липидов выражаются в уменьшении образования жира из углеводов, снижении в жировой ткани реосинтеза ТГ из жирных кислот, увеличении липолитического эффекта СТГ и АКТГ, которые в физиологических условиях подавляются инсулином. При этом увеличивается поступление из жировой ткани в кровь СЖК и уменьшается отложение в ней липидов. Часть циркулирующих в крови СЖК ресинтезируется в печени в ТГ, что способствует развитию жировой дистрофии печени, а при нарушении продукции липокаина в печени начинается интенсивное образование кетоновых тел и развивается гиперхолестеринемия.
Большинство исследователей считают, что у больных сахарным диабетом, так же как и у здоровых беременных, происходит повышение уровня липидных фракций по мере увеличения срока беременности. По данным S. Kryten и соавт. (1976), увеличение содержания холестерола и ТГ у беременных, больных сахарным диабетом, начинается с 10-й недели беременности, и к III триместру содержание холестерола увеличивается на 37%, а ТГ - на 185%. В то же время, согласно наблюдениям Pantelakis, в более поздние сроки беременности уровень липидов у женщин, больных сахарным диабетом, не отличается от такового у здоровых. Содержание СЖК и ТГ у беременных, больных сахарным диабетом, превышает соответствующие показатели у здоровых беременных.
Perssou и Luneli (1975) исследовали содержание глюкозы и СЖК в плазме крови беременных, больных сахарным диабетом, в последние 8 - 10 нед беременности. Оказалось, что концентрация СЖК в крови беременных, больных сахарным диабетом, была значительно выше, чем у здоровых, и в отличие от контрольной группы не наблюдалось нормальной обратной зависимости между уровнем глюкозы натощак и концентрацией неэстерифицированных жирных кислот (НЭЖК).
В исследованиях Т. В. Себко (1977) и С. В. Уголевой (1977) было обнаружено, что нарушения липидного спектра крови у беременных, больных сахарным диабетом, зависели от тяжести основного заболевания, присоединения характерных для сахарного" диабета осложнений и состояния углеводного обмена.
Повышенная активность адренергического звена САС способствует повышению концентрации липидов в крови беременных, больных сахарным диабетом. После достижения компенсации заболевания уровень СЖК и фосфолипидов достоверно не отличался от соответствующих показателей у здоровых беременных, в то же время содержание ТГ и во время компенсации было выше такового в контроле.
По вопросу о содержании СЖК у рожениц, больных сахарным диабетом, единого мнения нет. Согласно данным одних авторов, уровень СЖК у больных сахарным диабетом незначительно выше, чем у здоровых рожениц, по мнению других - ниже. Эти противоречия в основном обусловлены небольшим количеством клинических наблюдений. Как показали исследования Т. В. Себко (1977), у рожениц, страдающих сахарным диабетом, по сравнению со здоровыми в крови отмечается увеличение всех липидных фракций, особенно СЖК. Полученные данные свидетельствуют о том, что липиды активно участвуют в формировании ответной реакции организма на родовой стресс.
При изучении особенностей липидного обмена у плодов и новорожденных от больных сахарным диабетом матерей выявлены значительные его нарушения. Mortimer (1964) отмечает, что средние показатели содержания фосфолипидов, свободного холестерина и его эфиров у детей от матерей, больных сахарным диабетом, выше, чем у детей здоровых женщин. Это, по мнению автора, объясняется переходом СЖК от матери. Уровень СЖК у плодов от матерей, больных сахарным диабетом, несколько выше, чем у плодов здоровых рожениц, при этом наиболее высокое содержание СЖК обнаружено у плодов, матери которых получали инсулинотерапию. Низкий уровень СЖК обнаружен у плодов от матерей с потенциальным диабетом. По-видимому, внутриутробно развивающаяся у этих детей гиперплазия поджелудочной железы способствует повышению инсулиновой активности крови и активации процессов липогенеза.
Таким образом, исследования липидного спектра крови представляют большой теоретический и практический интерес, однако в основном они посвящены изучению отдельных фракций липидов. Нередко эти исследования основаны на небольшом числе клинических наблюдений, и поэтому их результаты не вполне достоверны. Полученные нами данные об особенностях липидного обмена у больных сахарным диабетом представлены в табл. 1.

Таблица 1. Липидный спектр крови у здоровых и больных сахарным диабетом беременных
Как видно из табл. 1, состояние липидного обмена у беременных, больных сахарным диабетом, характеризуется умеренным повышением уровня всех липидов, особенно ТГ. Наиболее выраженное увеличение содержания ТГ можно рассматривать не только как результат липосинтетических процессов (повышенный синтез и ресинтез ТГ из жирных кислот), но и как проявление инсулиновой недостаточности (гидролиз ТГ в составе хиломикронов и Р-липопротеидов при активации липопротеинлипазы и последующее замедленное поступление их в жировую ткань из-за нарушения пиноцитоза).
В то же время повышение при сахарном диабете содержания в крови всех липидных фракций, особенно холестерина, материалом для синтеза которого служит избыток ацетатов, образующихся при окислении жирных кислот, равно как и умеренное повышение уровня СЖК, свидетельствует об активации липолитических процессов при этом заболевании.
Таким образом, характерный для беременных, больных сахарным диабетом, обмен липидов отражает неустойчивое равновесие процессов липоспнтеза и липолиза, которое легко может быть сдвинуто в сторону липолиза. Умеренное повышение уровня всех липидных фракций свидетельствует о недостаточной компенсации липидного обмена, хотя применением адекватного лечения удается несколько затормозить процессы липолиза, истощающие энергетические фонды организма.
Влияние тяжести диабета на состояние липидного спектра крови обследованных беременных проявилось в достоверном увеличении содержания всех липидных фракций у больных с более тяжелым течением заболевания (табл. 2).

Таблица 2. Липидный спектр крови беременных при различной тяжести сахарного диабета
Как следует из табл. 2, если уровень липидных фракций у беременных с ИНЗД принять за 100%, то соответствующие показатели у больных с ИЗД составят: для свободного холестерина 134%, СЖК 161%, ТГ 152% и эфиров холестерина 139%. Это свидетельствует о значительном преобладании процессов липолиза.
При определении в обеих группах обследованных соотношения гормонов, регулирующих липидный обмен, установлено, что величина коэффициента С-пептид/СТГ+АКТГ+адреналин, характеризующего преобладание секреторной активности гормонов с липосинтетическим или липолитическим эффектом действия, у беременных с ИЗД была в 2 раза ниже, несмотря на то что уровень липолитических гормонов гипофиза и надпочечников в этой группе также был ниже (СТГ 2,86±0,62 нг/мл, АКТГ 89,19±21,12 нг/мл и адреналина 2,39±0,57 нг/мл), чем соответствующие показатели у беременных с более легким течением заболевания (соответственно 8,1±2,50, 142,67±31,54 и 3,66±0,92 нг/мл). Это обусловлено значительным уменьшением при более тяжелом течении диабета истинной секреции инсулина, о чем свидетельствует достоверное снижение у этих больных уровня С-пептида (31% по отношению к 100% при ИНЗД).
Таким образом, согласно полученным нами данным, причиной выявленных у беременных с ИЗД значительных нарушений липидного обмена является выраженная инсулиновая недостаточность, которая не была полностью устранена, несмотря на то что соответствующими лечебными мероприятиями удалось снизить у беременных уровень гликемии до субнормальных цифр.
Вызванный относительной или абсолютной инсулиновой недостаточностью дефицит инсулина ограничивает поступление в жировую ткань глюкозы и окисление ее по пентозному циклу, тормозит образование жира из глюкозы и ресинтез ТГ из высших жирных кислот, задерживает их поступление из крови в жировую ткань путем пиноцитоза, усиливает их расщепление в жировой ткани (липолиз), что приводит к увеличению поступления в кровь СЖК.
При нарушении утилизации глюкозы повышение уровня СЖК в крови является биологически важным для организма компенсаторным процессом, так как позволяет возместить дефицит энергии, возникающий при недостаточной утилизации глюкозы. Однако, поскольку СЖК являются негормональными антагонистами инсулина, продолжительное и выраженное повышение их уровня в крови оказывает неблагоприятное влияние на течение диабета, что ухудшает прогноз беременности для матери и плода. Это вызывает необходимость произвести быстрее полноценную компенсацию у беременных не только углеводного, но и липидного обмена.
Выявленное у обследованных беременных повышение уровня ТГ может быть вызвано затрудненным их переходом в жировую ткань в результате нарушения пиноцитоза, а также замедленным выведением ТГ из крови в результате снижения активности фермента липопротеинлипазы, который гидролизует ТГ. Известно, что переход липопротеинлипазы из неактивной в активную форму происходит при участии аденилциклазной системы, активируемой в основном адреналином, уровень которого у обследованных нами беременных оказался сниженным. Это в свою очередь способствует снижению уровня цАМФ, который является регулятором скорости липолитических процессов в организме. Таким образом, можно сделать вывод о снижении динамики процессов лппосинтеза - липолиза, особенно при тяжелых формах диабета.
При сравнительном анализе показателей липидного спектра крови здоровых и больных сахарным диабетом рожениц, у которых роды произошли без осложнений через естественные родовые пути, было установлено, что при сахарном диабете уровень липидных фракций несколько превышает таковой в контроле: 111% свободного холестерина, 123,4% ТГ, 115,2% эфиров холестерина и 102,6% СЖК (табл. 3).

Таблица 3. Липидный спектр крови здоровых и больных сахарным диабетом рожениц
Существовавшие при беременности различия в содержании СЖК в контрольной и основной группе практически нивелировались во время родов, что, с нашей точки зрения, обусловлено различной степенью реакции липидных фракций здоровых и больных сахарным диабетом женщин на родовой стресс.
Как показали проведенные исследования, по отношению к принятым за 100% соответствующим показателям при беременности уровень свободного холестерина как в контрольной, так и в основной группе составлял в родах 111%, содержание ТГ в обеих группах было равно 110%, а эфиров холестерина - соответственно 102 и 104%. В то же время концентрация СЖК достигала 137% у здоровых рожениц и 125% у рожениц, больных сахарным диабетом.
Таким образом, как у здоровых, так и у больных сахарным диабетом рожениц наиболее выраженными были изменения уровня СЖК, что свидетельствует о преобладании во время родов процессов липолиза. Однако на фоне усиления липолиза этот процесс при сахарном диабете был менее выражен, чем в контроле. Это, по-видимому, было связано с менее выраженной, чем у здоровых беременных, активацией липолитических гормонов в ответ на родовой стресс.
Так, у рожениц, больных сахарным диабетом, наряду с умеренным повышением во время родов (по сравнению с данными при беременности) секреции ИРИ (142,7% при сахарном диабете, 128,5% в контроле) выявлена заметно менее выраженная, чем у здоровых женщин, активация АКТГ (103,7% при сахарном диабете, 159% в контроле) и снижение секреции адреналина (73,4% при сахарном диабете, 194% в контроле).
Отсутствие при сахарном диабете достаточно сбалансированной гормональной реакции в ответ на родовой стресс в первую очередь отражается на уровне СЖК. Выявленное в основной группе п обусловленное неадекватным гормональным влиянием менее выраженное, чем в контроле, повышение уровня СЖК создает у рожениц, больных сахарным диабетом, реальную угрозу нарастания энергетического дефицита при возникновении стрессовых ситуаций. Это усугубляет декомпенсацию диабета (нарушение утилизации глюкозы, развитие кетоацидоза, возникновение гипогликемического состояния), приводит к ослаблению родовой деятельности и ухудшает состояние плода. В связи с этим понятна необходимость максимально бережного ведения родов у таких больных, строжайшего наблюдения за обменными процессами и регулярной их коррекции, а при выявлении осложнений - расширение показаний к абдоминальному родоразрешению.
При анализе показателей липидного спектра пуповинной крови плодов от матерей, больных сахарным диабетом, выявлены наиболее выраженные изменения уровня ТГ, в то время как содержание остальных липидных фракций практически не изменилось (табл. 4).
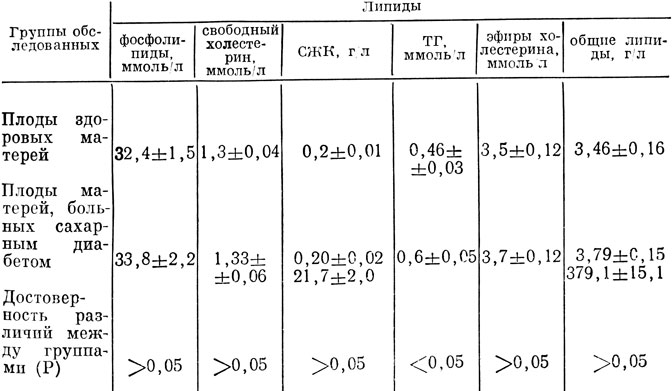
Таблица 4. Липидный спектр крови у плодов от здоровых и больных Сахарным диабетом матерей
Еще более выраженное повышение уровня фракции триглицеридов можно было наблюдать у плодов от матерей с тяжелым течением заболевания. Так, по сравнению с принятыми за 100% показателями липидограмм плодов от матерей с ИНЗД содержание отдельных фракций у плодов, матери которых больны ИЗД, было следующим: 108% свободного холестерина, 104% СЖК, 146% ТГ и 132% эфиров холестерина.
Таким образом, характерным для метаболизма липидов у плодов, матери которых страдают сахарным диабетом, следует считать повышение концентрации ТГ при почти неизмененном по сравнению со здоровыми плодами уровнем СЖК. Полученные нами данные совпадают с результатами наблюдений Oakley и соавт. (1972), которые для объяснения выявленной гипертриглицеридемии высказали предположение о возможном переходе СЖК от матери к плоду, в результате чего плод получает достаточно материала для активации липогенеза в жировой ткани.
Наличие прямой корреляционной связи между содержанием СЖК в крови рожениц, больных сахарным диабетом, и их плодов подтверждает возможность трансплацентарного перехода СЖК к плоду, однако на основании полученных данных мощно сделать вывод о доминирующем влиянии на состояние липидного обмена плода соотношения инсулярного и контринсулярных гормонов.
При сравнительном анализе гормонального статуса плодов от матерей, больных ИНЗД и ИЗД, у последних выявлено резко выраженное увеличение секреции С-пептида (342% при ИЗД и 100% при ИНЗД) на фоне небольшого снижения уровня контринсулярных гормонов гипофиза (СТГ до 73% и АКТГ 90,5%, глюкокортикоидов до 92%) и заметного повышения уровня адреналина (на 157%). Содержание глюкагона в обеих группах было практически одинаковым (соответственно 104 и 100%), при этом коэффициент C-пептид/глюкагон +АКТГ+СТГ+А у плодов от матерей с ИЗД был в 3 раза выше, чем в пуповинной крови плодов, матери которых не нуждались в постоянном проведении инсулинотерапии.
Таким образом, установлено значительное преобладание у плодов, матери которых страдают сахарным диабетом, особенно тяжелыми формами заболевания, липосинтетического влияния инсулина. В связи с этим можно сделать предположение, что независимо от перехода СЖК через трансплацентарный барьер основным фактором в происхождении гипертриглицеридемии плода является усиление процессов липосинтеза, обусловленное преобладающим влиянием на метаболизм липидов секреции инсулина. О превалировании липосинтеза над липолитическими процессами свидетельствует сравнительно невысокий уровень СЖК (104%), который является показателем равновесия в организме процессов липосинтеза и липолиза.
Особенности аминокислотного и белкового состава крови у больных сахарным диабетом рожениц и их плодов. Чрезвычайно важное значение для жизнедеятельности организма и плода имеют белки и аминокислоты. Они составляют структурную основу всех тканевых элементов, служат источником образования ряда биологически активных веществ, медиаторов, гормонов, ферментов, участвуют в транспорте электролитов, углеводных и липоидных комплексов и т. д. В связи с этим проведено большое количество исследований этих видов обмена у матери, плода и новорожденного при нормально протекающей и осложненной беременности.
Большое внимание состоянию белкового и аминокислотного метаболизма было также уделено при изучении проблемы сахарного диабета [Боднар П. Н., 1971; Бородулина О. В. и др., 1974; Алиев Т. А., Саруханов Ш. А., 1977; Borgmann, 1970, и др.]. Однако в литературе до настоящего времени опубликованы лишь единичные работы, посвященные изучению белково-аминокислотного метаболизма матери и плода при сахарном диабете. Изучение же состояния этих видов обмена, особенно участие их в гормонально-метаболических взаимоотношениях между больной сахарным диабетом матерью и ее плодом, представляет несомненный теоретический и практический интерес.
Проведенный нами сравнительный анализ аминокислотного состава крови у здоровых и больных неосложненным инсулинзависимым сахарным диабетом рожениц с одинаковой акушерской ситуацией (неосложненные роды через естественные родовые пути при сроке 37 - 40 нед, которые закончились рождением детей с массой тела 3 - 3,9 кг без признаков асфиксии) позволил установить у последних небольшое повышение уровня свободных аминокислот (табл. 5).
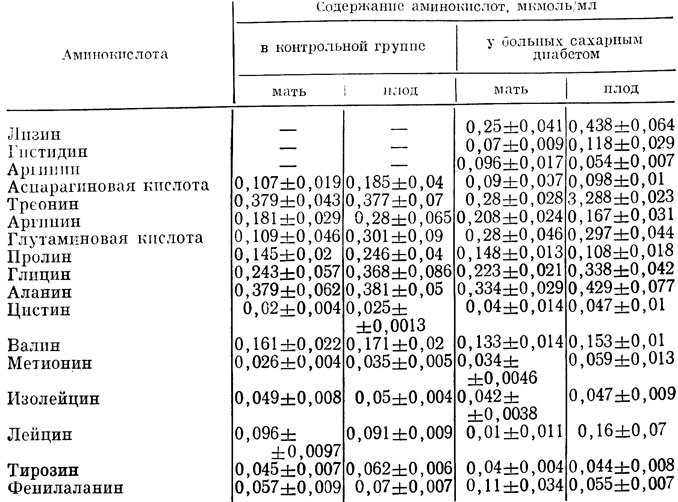
Таблица 5. Содержание свободных аминокислот в крови рожениц, больных сахарным диабетом, и их плодов
Так, суммарная концентрация свободных аминокислот в крови рожениц, больных сахарным диабетом, была равна 2,258 ммоль/мл, что составило 113% по отношению к 1,997 мrмоль/мл в контрольной группе.
Известно, что уровень свободных аминокислот в плазме крови в значительной степени зависит от интенсивности их утилизации клетками организма, которая в свою очередь определяется функциональной активностью гормональных систем с анаболическим и катаболическим действием. Инсулин облегчает переход аминокислот через клеточные мембраны внутрь клеток и таким образом повышает синтез белка. Гормон роста, усиливая окисление и мобилизацию жира, способствует освобождению энергии, необходимой для этого синтеза. В то же время под влиянием глюкокортикоидов и тироксина усиливается распад белка и замедляется синтез.
Таким образом, чем более выражена при сахарном диабете абсолютная или относительная недостаточность инсулина, сопровождающаяся компенсаторным повышением уровня глюкокортикоидов, тем в большей степени снижается уровень энергетического обмена и нарушается функциональная способность ферментов, необходимых для синтеза белка, снижается белковообразовательная функция печени и повышается образование углеводов из аминокислот и жиров. В результате процессы катаболизма белков начинают преобладать над их синтезом. Это приводит к повышению в крови уровня свободных аминокислот.
Можно предположить, что проводившаяся большинству обследованных нами рожениц адекватная инсулинотерапия позволила предотвратить резкое нарушение утилизации аминокислот. Об этом, помимо выявленных незначительных различий в суммарном содержании всех исследуемых аминокислот, свидетельствуют также практически одинаковая в обеих группах концентрация гликогенных аминокислот и нерезко выраженное снижение в исследуемой группе уровня аланина, который при недостаточной утилизации аминокислот и глюкозы используется в первую очередь для глюконеогенеза [Hall et al., 1977], В то же время у рожениц с декомпенсированным во время беременности течением заболевания суммарное содержание в крови свободных аминокислот было заметно выше (132%), а уровень аланина - ниже (0,329 мкмоль/мл).
Полученные нами данные позволяют сделать вывод о том, что у рожениц с неосложненным диабетом отмечается небольшое угнетение утилизации тканями свободных аминокислот, которое увеличивается при декомпенсированном течении заболевания. Таким образом, декомпенсация диабета при беременности приводит не только к нарушениям метаболизма углеводов и жиров, но также к заметным сдвигам в обмене аминокислот.
Наблюдения других авторов подтвердили полученные нами данные о значительно более высоком содержании аминокислот в крови плодов здоровых матерей, что отражает повышенную потребность плодов в этих веществах как пластическом материале. Так, соотношение суммарных концентраций аминокислот в крови плодов и их матерей составило в контрольной группе 1,32, а при сахарном диабете 1,02. При этом у плодов контрольной группы содержание большинства свободных аминокислот было выше, чем у матерей. Исключение составили треонин, аланин, лейцин и изолейцин, уровень которых практически не отличался от содержания этих аминокислот у рожениц.
При сахарном диабете в пуповинной крови плодов наряду с достоверным по сравнению с матерью повышением концентрации лизина, гистидина, глицина, валина и тенденцией к повышению содержания глутаминовой кислоты, аланина, метионина и лейцина отмечено также статистически достоверное снижение концентрации аргинина, аспарагиновой кислоты, пролина и фенилаланина. Эти данные расходятся с результатами наблюдений Cockburn и соавт. (1971), которые, исследуя аминокислотный спектр крови у рожениц, больных сахарным диабетом, и их плодов, обнаружили, что у последних содержание всех аминокислот, за исключением цитруллина, было выше, чем у матери. В то же время, согласно наблюдениям Ruthenberg и соавт. (1982), содержание свободных аминокислот в пуповинной крови плодов при сахарном диабете матери снижено.
В пуповинной крови обследованных нами плодов суммарная концентрация свободных аминокислот составила 87% по отношению к принятым за 100% показателям у плодов здоровых матерей. Сравнительный анализ отдельных аминокислот позволил установить наличие у обследованных плодов нерезко выраженного по сравнению с контролем уменьшения содержания треонина, серина, тирозина, валина и фенилаланина и значительное статистически достоверное снижение уровня аспарагиновой кислоты и пролина.
На этом фоне отмечалось значительное повышение уровня цистина и небольшое увеличение концентрации аланина, метионина и лейцина. Концентрация глутаминовой кислоты, глицина и изолейцина в обеих группах была практически одинаковой. Таким образом, в пуповинной крови плодов от больных сахарным диабетом матерей было уменьшено по сравнению с контролем содержание 7 и увеличено 4 из 14 исследованных аминокислот.
В то же время, по данным Horska и соавт. (1980), в крови новорожденных, матери которых страдали сахарным диабетом, было отмечено значительное повышение концентрации лизина, гистидина, цистиновой кислоты, таурина, серина, глутаминовой кислоты, глицина, аланина и фенилаланина.
Обращает на себя внимание также то обстоятельство, что при сахарном диабете как у матери, так и у плода происходит заметное изменение концентрации монодикарбоновых (глутаминовой и особенно аспарагиновой) кислот, которые играют значительную роль в важнейшей реакции аминокислотного обмена - реакции переаминирования. Вследствие этого глутаминовая и аспарагиновая кислоты связаны с циклом Кребса и одновременно являются источниками для синтеза белков, пуриновых и пиримидиновых оснований, обеспечивая тем самым прямую связь между белковым и углеводным обменом. Исходя из этого, можно предположить, что выявленные у матерей, больных сахарным диабетом, и их плодов сдвиги в системе дикарбоновых кислот являются проявлением не только возможного дисбаланса белка, но и недостаточно адекватной компенсации углеводного обмена.
Поскольку содержание в пуповинной крови свободных аминокислот зависит от величины их поступления к плоду и степени их утилизации клетками плода, отмеченное нами у плодов от матерей, больных сахарным диабетом, умеренное снижение уровня свободных аминокислот может быть вызвано любым из указанных выше факторов или их взаимодействием.
Если исходить из современных представлений о том, что в III триместре беременности количество и состав околоплодных вод в значительной степени определяется количеством и составом мочи плода, то на основании определения состояния аминокислотного состава вод можно получить представление об экскреции неутилизированных плодом аминокислот, а следовательно, и о степени их усвоения. Согласно полученным нами данным, суммарная концентрация исследуемых аминокислот в амниотической жидкости при сахарном диабете матери составляла 81% по сравнению со 100% в контроле, а отношение содержания свободных аминокислот в околоплодных водах к уровню их в крови плодов было равно соответственно 0,48 и 0,51 (табл. 6).

Таблица 6. Содержание аминокислот в околоплодных водах рожениц, больных сахарным диабетом
Следовательно, при сахарном диабете матери содержание неиспользованных плодом и экскретируемых с мочой аминокислот было несколько ниже, чем у плодов контрольной группы. При этом в амниотической жидкости больных сахарным диабетом концентрация 11 из 17 (в контрольной группе 7 из 14) аминокислот была достоверно ниже, чем в крови плода. Наиболее низкая степень экскреции, а следовательно, самая высокая утилизация были характерны при сахарном диабете для глутаминовой кислоты, метионина и лейцина. Таким образом, у плодов от больных сахарным диабетом матерей имеется достаточно активная, хотя и незначительно повышенная по сравнению с контролем, утилизация аминокислот.
Известно, что коэффициент околоплодные воды/кровь плода позволяет по количеству неиспользованных плодом и экскретируемых с мочой в амниотическую жидкость исследуемых веществ оценить степень их утилизации плодом. Коэффициент кровь плода/кровь матери является выражением двух процессов: поступления этих веществ от матери к плоду и их утилизации в организме плода. В связи с этим при сопоставлении этих коэффициентов можно получить представление о соотношении между активностью трансплацентарного перехода исследуемых веществ от матери к плоду и величиной их последующей утилизации.
Проведенный нами анализ позволил установить, что различие показателей коэффициента кровь плода/кровь матери по аминокислотам (1,32 в контрольной группе и 1,02 в основной) более выражено, чем различие показателей коэффициента околоплодные воды/кровь плода (0,51 и 0,48 соответственно). Это позволяет сделать вывод о том, что снижение уровня свободных аминокислот в пуповинной крови плодов от больных сахарным диабетом матерей обусловлено не только достаточно активной их утилизацией в организме плода, но и менее активным (несмотря на повышенное содержание в крови больной матери свободных аминокислот) поступлением их от матери к плоду.
Учитывая данные литературы о наличии при сахарном диабете множественных патологических изменений плаценты, можно предположить, что одним из факторов, способствующих изменению аминокислотного спектра крови плодов от больных сахарным диабетом матерей, являются изменения транспортной функции плаценты.
По вопросу о состоянии белкового состава крови при сахарном диабете среди исследователей до настоящего времени существуют значительные разногласия. С. Г. Генес (1953), И. Л. Малева (1961) и др. пришли к заключению, что наиболее характерной особенностью обмена белка при этом заболевании является выраженная гипо- и диспротеинемия. По мнению В. Г. Баранова (1977), при неосложненном течении заболевания характер протеинограммы у больных остается без изменений.
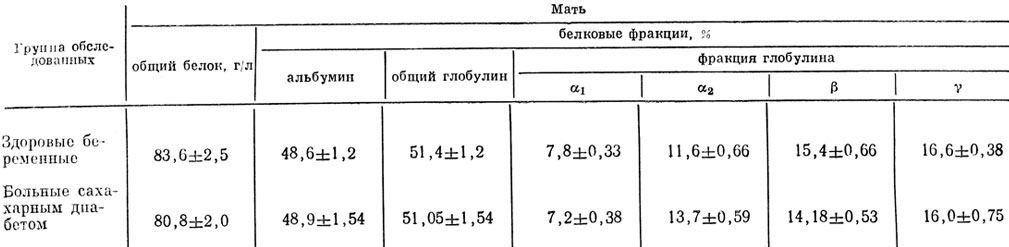

Таблица 7. Протеинограмма больных сахарным диабетом рожениц и их плодов
Проведенные нами исследования белкового состава крови у здоровых и больных сахарным диабетом рожениц позволили выявить при этом заболевании слабо выраженную тенденцию к снижению уровня общего белка крови при нормальном содержании альбуминов и глобулинов (табл. 7). Полученные нами данные подтверждают наблюдения В. Г. Баранова (1977), что, по-видимому, является результатом применения адекватной инсулинотерапии.
Как видно из табл. 7, для белкового состава крови плодов при неосложненном ИЗД матери характерно более низкое, чем у плодов здоровых матерей, содержание общего белка (79% при сахарном диабете и 100% в контроле) на фоне практически одинакового уровня альбуминов (соответственно 104 и 100%) и незначительного снижения глобулинов (94%). Со стороны глобулиновых фракций отмечалось заметное по сравнению с контролем повышение уровня β-глобулинов (116%) и снижение у-глобулинов (79%), в то время как уровень a-фракций оставался без изменений.
Выявленное у плодов основной группы по сравнению с контрольной снижение уровня общего белка крови, увеличение содержания β- и снижение уровня γ-глобулинов согласуется с данными Davidson (1971), работа которого до настоящего времени является практически единственным исследованием, обстоятельно освещающим особенности белкового состава крови плодов при сахарном диабете матери. Однако, по мнению Davidson (1971), плодам от больных матерей свойственно снижение всех белковых фракций, за исключением Р-глобулина, в то же время в наших исследованиях мы не выявили выраженной диспротеинемии. Действительно, согласно нашим наблюдениям, состояние белкового обмена у плодов от больных сахарным диабетом матерей характеризуется не столько качественными, сколько количественными изменениями.
Выявленные нами умеренные сдвиги аминокислотно-белкового состава крови рожениц, больных сахарным диабетом, тесно связаны с состоянием их гормонального статуса, для которого характерны наличие нерезко сниженной секреторной активности инсулярного аппарата и выраженная тенденция к компенсаторному повышению уровня кортизола.
Подавление при инсулиновой недостаточности анаболического эффекта действия инсулина в сочетании с катаболическим эффектом глюкокортикоидов способствует нарушению у рожениц, больных сахарным диабетом, утилизации свободных аминокислот и уменьшению синтеза белка. Планомерное проведение инсулинотерапии препятствовало дальнейшему развитию этого процесса, однако полной компенсации белкового обмена у них достигнуто не было.
Согласно нашим представлениям, свойственные плодам матерей, больных сахарным диабетом, особенности белкового состава крови обусловлены влиянием совокупности факторов с разнонаправленным действием. К ним относятся повышенная активность инсулярного аппарата плода и компенсаторное увеличение содержания глюкокортикоидов в сочетании с более выраженными, чем у матери, проявлениями хронической гипоксии (нарушение энергетического обеспечения синтеза белка) и некомпенсированного ацидоза (активация тканевых катепсинов), а также снижение интенсивности трансплацентарного перехода аминокислот от матери и функциональная незрелость их ферментативных систем. От функционального равновесия этих факторов во многом зависит преобладание в исследуемой группе плодов стимуляции анаболической или катаболической фазы белкового синтеза.
|
ПОИСК:
|
© ROGHDENIEREBENKA.RU, 2010-2019
При копировании материалов активная ссылка обязательна:
http://roghdenierebenka.ru/ 'Беременность, рождение и первые годы жизни ребёнка'
При копировании материалов активная ссылка обязательна:
http://roghdenierebenka.ru/ 'Беременность, рождение и первые годы жизни ребёнка'